题目内容
6.某化学兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠.设计装置如下(忽略装置中空气的影响),请回答下列问题:
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成.
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸.
(1)组装好仪器后,必须进行的一项操作是检查装置的气密性.
(2)推测B中可以观察到的主要现象是铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡;C装置的作用是除去NO中混有的CO2.
(3)装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是NaOH.可以通过适当改进,不产生Y物质,请你提出改进方法:用装有碱石灰的干燥管代替C装置.
(4)在酸性溶液中,NO2可将MnO4-还原为Mn2+.写出有关反应的离子方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O.
(5)E装置中试剂X可以是B.
A.稀硫酸 B.酸性高锰酸钾溶液 C.稀硝酸 D.水.
分析 以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠,由图可知,组装好仪器后,先检查装置的气密性,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中二氧化氮与水反应生成硝酸,然后Cu与硝酸反应生成一氧化氮,C中利用NaOH溶液吸收二氧化碳,在D中一氧化氮与过氧化钠反应生成亚硝酸钠,可能还发生水与过氧化钠的反应生成NaOH和氧气,最后通过酸性高锰酸钾溶液除去剩余一氧化氮防止污染空气,一氧化氮可被酸性KMnO4溶液氧化硝酸;结合信息可知在酸性溶液中,NO2-可将MnO4-还原为Mn2+,据氧化还原反应可知NO2-氧化生成NO3-,以此来解答,
(1)气体制备和性质验证需要装置气密性完好,开始前需要检验装置气密性;
(2)HNO3与铜反应,故铜片溶解,溶液变蓝,产生气泡,在通入D之前应先用氢氧化钠溶液将其除去NO中混有的CO2;
(3)水蒸气会进入装置D,过氧化钠和生成水i反应生成氢氧化钠和氧气,根据原子守恒可知,生成的固体物质应该还有NaOH,可以利用固体碱石灰既吸收杂质也会吸收水蒸气,对气体起到干燥作用;
(4)在酸性溶液中,NO2-可将MnO4-还原为Mn2+,NO2-氧化生成NO3-,结合电荷守恒和原子守恒配平书写离子方程式;
(5)过酸性高锰酸钾溶液除去剩余一氧化氮,生成硝酸;
解答 解:(1)组装好仪器后,必须进行的一项操作是检查装置的气密性,故答案为:检查装置的气密性;
(2)根据装置图可知,A中产生的NO2在B中与水反应生成HNO3和NO,其中HNO3与铜反应,故铜片溶解,溶液变蓝,产生气利用泡;由于A中还产生了CO2,故在通入D之前应先用氢氧化钠溶液将其除去NO中混有的CO2;
故答案为:铜片逐渐溶解,溶液逐渐变蓝,产生无色气泡;除去NO中混有的CO2;
(3)由于NO通过氢氧化钠溶液进入D装置时会带入水蒸气,根据原子守恒可知,生成的固体物质应该还有NaOH;若要避免生成NaOH,应该除去水蒸气,则改进方法为用装有碱石灰的干燥管代替C装置,
故答案为:NaOH;用装有碱石灰的干燥管代替C装置;
(4)在酸性溶液中,NO2-可将MnO4-还原为Mn2+,NO2-氧化生成NO3-,离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
(5)通过酸性高锰酸钾溶液除去剩余一氧化氮,生成硝酸,防止污染空气,故选B,
故答案为:B.
点评 本题考查性质实验方案及实验装置的评价,把握装置的作用、气体的制备实验等为解答的关键,侧重分析与实验能力的考查,注意氮族元素化合物知识的综合应用,题目难度中等.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案| A. | 传统的无机混凝剂按金属盐可分为铝盐系和铁盐系两大类 | |
| B. | NCl3可用于水消毒的原因是NCl3跟水反应生成了NH3 | |
| C. | 用ClO2代替Cl2作消毒剂可减小水中有害氯代有机物的浓度 | |
| D. | 新型水处理剂高铁酸钠(Na2FeO4)既是消毒剂又是混凝剂 |
| A. | C9H12 | B. | C17H20 | C. | C20H30 | D. | C12H20 |
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v(D)=30 mol•L-1•min-1 |
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 16 g O2和O3的混合气体中,所含氧原子数为0.5NA | |
| C. | 5.6 g 铁在足量氯气中燃烧,转移电子数为0.2 NA | |
| D. | 9g D2O所含的中子数为4.5NA |
| A. | 向沸水中滴加饱和氯化铁溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| B. | 氯化银溶于浓氨水:AgCl+2NH3•H2O=[Ag(NH3)2]Cl+2H2O | |
| C. | 工业上制取漂白粉:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | NaNO2溶液中加入酸性高锰酸钾溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O |
| A. | 五氯化磷 | B. | 过氧化氢 | C. | 氟化氢 | D. | CCl4 |
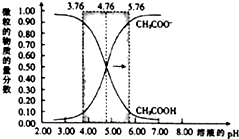 25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )
25℃时,在c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的溶液中,两种微粒的物质的量分数随溶液pH的变化如图所示(已知pKa=-lgKa),下列有关叙述错误的是( )| A. | 当溶液pH=3.76时,c(CH3COOH)>c(CH3COO-) | |
| B. | 当溶液pH=4.76时,c(CH3COO-)=c(CH3COOH)>c(OH-)=c(H+) | |
| C. | 当溶液pH=5.76时,CH3COO-的物质的量分数约为0.91 | |
| D. | 当溶液3<pH<7时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=10(pH-pKa) |
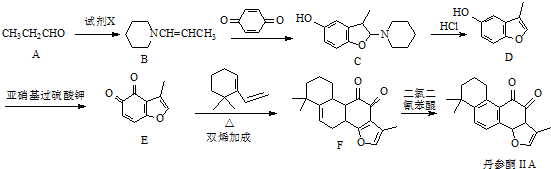
 .
. .
.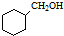 的合成路线流程图(无机试剂可任选).
的合成路线流程图(无机试剂可任选).