题目内容
4.化合物H是一种香料,存在于金橘中,可用如图路线合成: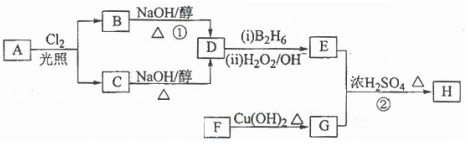
已知:R-CH=CH2$→_{(Ⅱ)H_{2}O_{2}/OH-}^{(Ⅰ)B_{2}H_{6}Ⅱ}$RCH2CH2OH(B2H6为乙硼烷)
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O.A的分子式是C4H10;
(2)B和C均为一氯代烃,且B分子的核磁共振氢谱图中只有一个吸收峰,它们的名称(系统命名)分别为2-甲基-2-氯丙烷、2-甲基-1-氯丙烷;
(3)在催化剂存在下1molF与2molH2反应,生成3-苯基-1-丙醇.F的结构简式是
 ;
;(4)反应①的反应类型是消去反应;反应②的反应类型是酯化反应或取代反应;
(5)反应②的化学方程式为
 .
.(6)反应①的化学方程式为(CH3)3CCl+NaOH$→_{△}^{醇}$NaCl+CH2=C(CH3)2.
分析 88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,B分子的核磁共振氢谱图中只有一个吸收峰,则B为2-甲基-2-氯丙烷,所以C为2-甲基-1-氯丙烷,D发生信息中的反应生成E为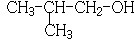 .F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为
.F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为 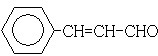 ,F中醛基氧化为羧基生成G为
,F中醛基氧化为羧基生成G为 ,D与E发生酯化反应生成H为
,D与E发生酯化反应生成H为 ,据此进行解答.
,据此进行解答.
解答 解:88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,B分子的核磁共振氢谱图中只有一个吸收峰,则B为2-甲基-2-氯丙烷,所以C为2-甲基-1-氯丙烷,D发生信息中的反应生成E为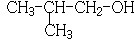 .F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为
.F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键,从生成的产物3-苯基-1-丙醇分析,F的结构简式为 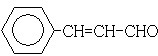 ,F中醛基氧化为羧基生成G为
,F中醛基氧化为羧基生成G为 ,D与E发生酯化反应生成H为
,D与E发生酯化反应生成H为 ,
,
(1)根据分析可知,A的学式为C4H10,
故答案为:C4H10;
(2)根据上面的分析可知,B为2-甲基-2-氯丙烷,C为2-甲基-1-氯丙烷,
故答案为:2-甲基-2-氯丙烷;2-甲基-1-氯丙烷;
(3)F可以与Cu(OH)2反应,故应为醛基,与H2之间为1:2加成,则应含有碳碳双键.从生成的产物3-苯基-1-丙醇分析,F的结构简式为 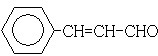 ,
,
故答案为: ;
;
(4)反应①为卤代烃在醇溶液中的消去反应;反应②为 ,该反应为酯化反应或取代反应,
,该反应为酯化反应或取代反应,
故答案为:消去反应;酯化反应或取代反应;
(5)G为 ,E为
,E为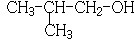 ,E与G在浓硫酸作用下可以发生酯化反应生成
,E与G在浓硫酸作用下可以发生酯化反应生成 ,反应方程式为:
,反应方程式为: ,
,
故答案为: ;
;
(6)B为2-甲基-2-氯丙烷,在氢氧化钠的醇溶液中发生消去反应生成CH2=C(CH3)2,该反应的化学方程式为:(CH3)3CCl+NaOH$→_{△}^{醇}$NaCl+CH2=C(CH3)2,
故答案为:(CH3)3CCl+NaOH$→_{△}^{醇}$NaCl+CH2=C(CH3)2.
点评 本题有机物的推断与合成,涉及分子式的判断、反应类型、化学方程式的书写以及同分异构体的判断等,注意把握推断题的关键点和题中重要信息,积累基础知识,以及知识的综合利用.

| A. | 乙醇 | B. | 乙醚 | C. | 己烯 | D. | 苯 |
| A. | C5H12O的醇有8种结构 | B. | 分子式为C4H8的链烃有2种 | ||
| C. | C4H8O2的酯有4种结构 | D. | C9H12含苯环的烃有8种 |
| A. | 推广和鼓励多使用公共交通工具出行 | |
| B. | 植树造林,绿化环境 | |
| C. | 利用廉价煤炭,大力发展火力发电 | |
| D. | 对燃煤进行脱硫,减少空气的污染 |
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
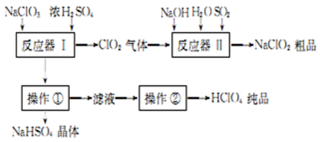
(1)操作①的名称是过滤,操作②的名称是蒸馏.
(2)反应器Ⅰ中发生反应的化学方程式为3NaClO3+3H2SO4=HClO4+2ClO2↑+3NaHSO4+H2O.
(3)反应器Ⅱ中发生反应的离子方程式为4OH-+SO2+2ClO2=2ClO2-+SO42-+2H2O.
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O.
(5)若想得到201 kg的 HClO4纯品,至少需要NaClO3 639 kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现)HCl+4H2O-8e-=HClO4+8H+.
| A. | 字航员喝茶时注入的H2O的摩尔质量是18克 | |
| B. | H2O+Cl2?HCl+HClO这反应属于氧化还原反应 | |
| C. | 氢的三种同位素1H、2D、3T与18O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
| A. | 化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物物质的量的增加 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指1秒钟时某物质的浓度为0.8mol•L-1 | |
| C. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 |