题目内容
10.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol•L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )| A. | 原混合溶液中c(K+)为1 mol•L-1 | |
| B. | 上述电解过程中共转移4 mol电子 | |
| C. | 电解得到的Cu的物质的量为0.5 mol | |
| D. | 电解后溶液中c(H+)为2 mol•L-1 |
分析 石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),阴极发生反应为:Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生反应为:4OH--4e-═O2↑+2H2O,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电子守恒及物质的量浓度的计算来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,
阳极发生电极反应为:4OH--4e-═O2↑+2H2O,
4mol 4mol 1mol
阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑
1mol 2mol 1mol 2mol 2mol 1mol
A.c(Cu2+)=$\frac{1mol}{0.5}$=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故A错误;
B.根据氧气计算转移电子的物质的量,转移电子的物质的量为1mol×4=4mol,故B正确;
C.电解得到的Cu的物质的量为1mol,故C错误;
D.电解后溶液中c(H+)为:$\frac{4mol-2mol}{0.5L}$=4mol/L,故D错误;
故选B.
点评 本题考查混合物计算,为高频考点和常见题型,题目难度中等,明确发生的电极反应及电子守恒是解答本题的关键,难点是A,注意根据电荷守恒计算,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.已知LiAl/FeS电池是一种新型的车载电池,对该电池充电时,阳极的电极反应式为:Li2S+Fe-2e-=2Li++FeS.下列有关该电池的说法中,正确的是( )
| A. | 化合物LiAl具有强还原性,作负极材料 | |
| B. | 为了延长电池的使用寿命,可以隔一段时间添加含电解质的水溶液 | |
| C. | 放电时,该电池的总反应式为2Li+FeS═Li2S+Fe | |
| D. | 放电时,当电路中0.1mol电子的电量时,有0.1molLi+向LiAl移动 |
12.下列各图与表述一致的是( )
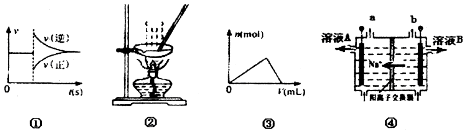

| A. | 图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 用图2所示装置蒸发FeCl3溶液制备无水FeCl3 | |
| C. | 曲线图③可以表示向一定量的明矾溶液中逐滴摘加一定浓度氢氧饭化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 图④电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
9.表给出了X、Y、Z、W四种短周期主族元素的部分信息.请根据这些信息判断下列说法中正确的是( )
| 元素 | X | Y | Z | W |
| 原子半径 | 0.102 | 0.16 | 0.074 | 0.071 |
| 最高正价或最低负价 | +6 | +2 | -2 | -1 |
| A. | HW是热稳定性最强的氢化物 | |
| B. | Z的最高正价为+6 | |
| C. | 原子序数X>Y>Z>W | |
| D. | 纯净的X单质与纯净的Z单质反应生成XZ3 |
15.25℃时,下列溶液中的微粒浓度关系正确的是( )
| A. | pH=3的0.1mol•L-1的NaHC2O4溶液中:c(C2O42-)<c(H2C2O4) | |
| B. | 0.1mol•L-1的Na2S溶液中:2c(Na+)=c(S2-)+c(HS-)+c(H2S) | |
| C. | pH=4的CH3COOH溶液中:$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-10 | |
| D. | 等物质的量浓度、等体积的NaF溶液和HF溶液混合所得的稀溶液中:c(H+)+c(Na+)=c(F-)+c(OH-) |
2.以下反应生成的有机物为纯净物的是( )
| A. | CH4和Cl2光照 | B. | 氯乙烯发生加聚反应 | ||
| C. | 正丙醇、异丙醇、浓硫酸共热至170℃ | D. | 甲醇、乙醇、浓硫酸共热至140℃ |
19. 如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )| A. | X是负极,Y是正极 | B. | Cu电极逐渐溶解 | ||
| C. | CuSO4溶液的pH逐渐减小 | D. | CuSO4溶液的pH不变 |
20.为探究铝片与不同浓度氯化铜溶液的反应,某学习小组将打磨好的同样大小的小块铝片放入3mL不同浓度CuCl2溶液中进行了如表实验:
(1)①推测红色固体是铜,写出生成铜反应的离子方程式2Al+3 Cu2+=2Al3++3Cu
②部分同学提出假设,认为红色固体中可能含有红色的氧化亚铜,查阅资料:
i. 氧化亚铜能溶于氯化铁溶液生成铜盐.
ii.氧化亚铜能溶于浓氨水形成无色配合物[Cu(NH3)2]+,其在空气中易被氧化成蓝色的[Cu(NH3)4(H2O)2]2+.
进行如下实验:将实验I所得溶液过滤,洗涤,加入浓氨水震荡,静置一段时间后溶液未变蓝色,证明红色固体中不含氧化亚铜.
(2)推测气体是氢气,写出氯化铜溶液显酸性的离子方程式:Cu2++2H2O=Cu(OH)2+2 H+.
试从以下角度分析开始一段时间内产生气体的速率不断加快的原因:
①浓度:随着反应的进行c(Al3+)增大,水解产生的c(H+)增大,产生氢气的速率加快.
②能量:因反应放热,温度升高,产生氢气的速率加快.
③电化学:铝与置换出的铜构成铝铜原电池,产生氢气的速率加快.
(3)探究白色沉淀的成分:
取实验ii所得混合液过滤,洗涤.将所得固体分成两份,一份加入浓盐酸,震荡白色沉淀消失:另一份加入浓氨水溶液,白色沉淀消失.
资料1:CuCl为白色固体,难溶于水,溶于浓盐酸,溶于浓氨水成无色溶液;CuCl与氢氧化钠反应转化为CuOH为橙黄色沉淀.
资料2:制备CuCl的方法有二
i.Cu和CuCl2在浓盐酸中反应,将得到的溶液稀释后生成CuCl
ii.Cu和CuCl2溶液加热即可得到CuCl
①推测白色沉淀中不含Al(OH)3,判断依据是加入浓氨水,白色沉淀不消失含有Al(OH)3,反之不含,因 Al(OH)3是两性氢氧化物,但不溶于弱碱氨水.
②推测白色沉淀是CuCl,探究白色沉淀的形成过程.设计实验:取3mL,2.00mol/LCuCl2溶液加入少量Cu粉并加热证明该白色沉淀的生成与铝和氯化铝无关.
③在白色沉淀中加入氢氧化钠溶液,产生橙黄色沉淀,从平衡移动角度进行解释:CuCl在水溶液中存在溶解平衡CuCl(S)?Cu+(aq)+Cl-(aq),加入氢氧化钠溶液,Cu+与反应生成橙黄色的CuOH沉淀,使溶解平衡正向移动,实现沉淀转化.
| 实验 | c(CuCl2) | 实验现象 |
| I | 0.25mol/L | 有红色固体析出,有气泡冒出,一段时间内出气速率加快. |
| II | 2.00mol/L | 反应剧烈,有红色固体析出,产生大量气泡,有白色难溶物,试管外壁温度明显升高,一段时间内出气速率加快. |
②部分同学提出假设,认为红色固体中可能含有红色的氧化亚铜,查阅资料:
i. 氧化亚铜能溶于氯化铁溶液生成铜盐.
ii.氧化亚铜能溶于浓氨水形成无色配合物[Cu(NH3)2]+,其在空气中易被氧化成蓝色的[Cu(NH3)4(H2O)2]2+.
进行如下实验:将实验I所得溶液过滤,洗涤,加入浓氨水震荡,静置一段时间后溶液未变蓝色,证明红色固体中不含氧化亚铜.
(2)推测气体是氢气,写出氯化铜溶液显酸性的离子方程式:Cu2++2H2O=Cu(OH)2+2 H+.
试从以下角度分析开始一段时间内产生气体的速率不断加快的原因:
①浓度:随着反应的进行c(Al3+)增大,水解产生的c(H+)增大,产生氢气的速率加快.
②能量:因反应放热,温度升高,产生氢气的速率加快.
③电化学:铝与置换出的铜构成铝铜原电池,产生氢气的速率加快.
(3)探究白色沉淀的成分:
取实验ii所得混合液过滤,洗涤.将所得固体分成两份,一份加入浓盐酸,震荡白色沉淀消失:另一份加入浓氨水溶液,白色沉淀消失.
资料1:CuCl为白色固体,难溶于水,溶于浓盐酸,溶于浓氨水成无色溶液;CuCl与氢氧化钠反应转化为CuOH为橙黄色沉淀.
资料2:制备CuCl的方法有二
i.Cu和CuCl2在浓盐酸中反应,将得到的溶液稀释后生成CuCl
ii.Cu和CuCl2溶液加热即可得到CuCl
①推测白色沉淀中不含Al(OH)3,判断依据是加入浓氨水,白色沉淀不消失含有Al(OH)3,反之不含,因 Al(OH)3是两性氢氧化物,但不溶于弱碱氨水.
②推测白色沉淀是CuCl,探究白色沉淀的形成过程.设计实验:取3mL,2.00mol/LCuCl2溶液加入少量Cu粉并加热证明该白色沉淀的生成与铝和氯化铝无关.
③在白色沉淀中加入氢氧化钠溶液,产生橙黄色沉淀,从平衡移动角度进行解释:CuCl在水溶液中存在溶解平衡CuCl(S)?Cu+(aq)+Cl-(aq),加入氢氧化钠溶液,Cu+与反应生成橙黄色的CuOH沉淀,使溶解平衡正向移动,实现沉淀转化.