题目内容
已知化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数为K2.
在温度973K和1173K情况下,K1、K2的值分别如下:
(1)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),平衡常数为K3
①请根据反应①与②可推导出K1、K2与K3之间的关系式为 .据此关系式及上表数据,也能推断出反应③是 (填“吸热”或“放热”)反应.
②图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况
i图甲中t2时刻发生改变的条件是 (答出所有可能情况).
ii图乙中t2时刻发生改变的条件是 (答出所有可能情况).
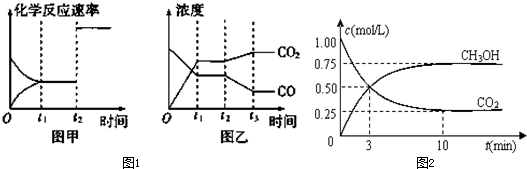
(2)在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应.
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.47kJ/mol
有关物质的浓度随时间变化如图所示.
①从反应开始到平衡,H2的平均反应速率v(H2)= .
②若其它条件不变,只将温度提高到800℃,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”).
(3)上述反应中的氢气还可用于工业上合成氨气.请回答下列问题:
在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3?H2O的电离常数Kb= .
化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数为K2.
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
①请根据反应①与②可推导出K1、K2与K3之间的关系式为
②图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况
i图甲中t2时刻发生改变的条件是
ii图乙中t2时刻发生改变的条件是

(2)在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应.
CO2(g)+3H2(g)
| ||
| 101kPa |
有关物质的浓度随时间变化如图所示.
①从反应开始到平衡,H2的平均反应速率v(H2)=
②若其它条件不变,只将温度提高到800℃,再次达平衡时,n(CH3OH)/n(CO2)比值
(3)上述反应中的氢气还可用于工业上合成氨气.请回答下列问题:
在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),用含a的代数式表示NH3?H2O的电离常数Kb=
考点:化学平衡的影响因素,物质的量或浓度随时间的变化曲线,弱电解质在水溶液中的电离平衡
专题:基本概念与基本理论
分析:(1)①依据反应①②③平衡常数表达式计算推出K3的计算式;
②根据图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,然后化学平衡影响因素分析平衡移动方向;
根据图乙中t2时刻改变条件,平衡向逆反应方向移动,然后化学平衡影响因素分析平衡移动方向;
(2)①图象分析计算甲醇的反应速率,结合速率之比等于化学方程式计量数之比得到氢气反应速率;
②反应是放热反应,升温平衡逆向进行;
(3)结合溶液的电荷守恒以及电离平衡常数概念解答.
②根据图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,然后化学平衡影响因素分析平衡移动方向;
根据图乙中t2时刻改变条件,平衡向逆反应方向移动,然后化学平衡影响因素分析平衡移动方向;
(2)①图象分析计算甲醇的反应速率,结合速率之比等于化学方程式计量数之比得到氢气反应速率;
②反应是放热反应,升温平衡逆向进行;
(3)结合溶液的电荷守恒以及电离平衡常数概念解答.
解答:
解:(1)①根据反应①与②可推导出K1、K2与K3之间的关系式:
化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1=
;
化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数为K2=
;
化学反应③:CO2(g)+H2(g)=CO(g)+H2O(g),平衡常数为K3 =
K3=
=
;
温度为973K时K3=
=0.62,温度为1173K时K3=
=1.29,
温度升高,平衡常数增大.说明正反应是吸热反应,
故答案为:
;吸热;
②图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,改变的条件为增大压强或加入催化剂,图乙中t2时刻改变条件,平衡向逆反应方向移动,二氧化碳浓度增大,一氧化碳浓度减小,可以采用降低温度或增大水蒸气的浓度或减小氢气的浓度,
故答案为:增大压强或加入催化剂;降低温度或增大水蒸气的浓度或减小氢气的浓度;
(2)①从反应开始到平衡甲醇浓度变化0.75mol/L?min,反应速率V(H2)=3V(CH3OH)=3×
=0.225 mol/(L?min),
故答案为:0.225 mol/(L?min);
②若其它条件不变,只将温度提高到800℃,反应是放热反应,平衡逆向进行,再次达平衡时,n(CH3OH)/n(CO2)比值减小,故答案为:减小;
(3)根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
×0.01mol?L-1=0.005mol?L-1,故混合后溶液中c(NH3.H2O)=
amol?L-1-0.005mol?L-1=(0.5a-0.005)mol/L,
NH3?H2O的电离常数Kb=
=
,
故答案为:
.
化学反应①:Fe(s)+CO2(g)=FeO(s)+CO(g),其平衡常数为K1=
| c(CO) |
| c(CO2) |
化学反应②:Fe(s)+H2O(g)=FeO(s)+H2(g),其平衡常数为K2=
| c(H2) |
| c(H2O) |
化学反应③:CO2(g)+H2(g)=CO(g)+H2O(g),平衡常数为K3 =
| c(CO)c(H2O) |
| c(CO2)c(H2) |
K3=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| K1 |
| K2 |
温度为973K时K3=
| 1.47 |
| 2.38 |
| 2.15 |
| 1.67 |
温度升高,平衡常数增大.说明正反应是吸热反应,
故答案为:
| K1 |
| K2 |
②图甲中t2时刻改变条件,正逆反应速率都增大但平衡不移动,改变的条件为增大压强或加入催化剂,图乙中t2时刻改变条件,平衡向逆反应方向移动,二氧化碳浓度增大,一氧化碳浓度减小,可以采用降低温度或增大水蒸气的浓度或减小氢气的浓度,
故答案为:增大压强或加入催化剂;降低温度或增大水蒸气的浓度或减小氢气的浓度;
(2)①从反应开始到平衡甲醇浓度变化0.75mol/L?min,反应速率V(H2)=3V(CH3OH)=3×
| 0.75mol/L |
| 10min |
故答案为:0.225 mol/(L?min);
②若其它条件不变,只将温度提高到800℃,反应是放热反应,平衡逆向进行,再次达平衡时,n(CH3OH)/n(CO2)比值减小,故答案为:减小;
(3)根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=
| 1 |
| 2 |
| 1 |
| 2 |
NH3?H2O的电离常数Kb=
| 10-7×0.005 |
| 0.5a-0.005 |
| 10-9 |
| a-0.01 |
故答案为:
| 10-9 |
| a-0.01 |
点评:本题考查化学平衡影响因素的分析判断,平衡常数的计算应用,数据处理的能力,题目难度中等.

练习册系列答案
相关题目
下列离子方式书写正确的是( )
| A、已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- |
| B、向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO3-═3Br2+2NO↑+4H2O |
| C、Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O═S↓+Cl-+2OH- |
| D、双氧水使酸性KMnO4溶液褪色:2MnO4-+5H2O2═2Mn2++5O2↑+6OH-+2H2O |
下列说法正确的是( )
| A、PM2.5表示每立方米空气中直径小于或等于2.5毫米的颗粒物的含量 |
| B、将浸泡过高锰酸钾溶液的硅藻土放入新鲜的水果箱内是为了催熟水果 |
| C、2013年11月29日,“夺命快递”事件源于氟乙酸甲酯泄漏,其结构简式为CH2FCOOCH3 |
| D、绿色化学的核心是利用化学原理治理污染 |
0.1molL-1的K2S溶液中,有关粒子的浓度大小关系正确的是( )
| A、c(K+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B、c(K+)+c(S2-)=0.3molL-1 |
| C、c(K+)=c(S2-)+c(HS-)+c(H2S) |
| D、c(OH-)=c(H+)+c(HS-)+2c(H2S) |

 利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.
利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水等.