题目内容
4.下列关于化学与能源、环保等相关说法正确的是( )| A. | 太阳能光电池的主要成份是单质硅 | |
| B. | 核电站泄漏的放射性碘-131(${\;}_{53}^{131}$I)、铯-137(${\;}_{55}^{137}$Cs)互称同位素 | |
| C. | 汽车尾气污染物中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| D. | 某雨水样品放置一段时间后pH由4.68变为4.28,是因为吸收了CO2 |
分析 A.晶体硅具有导电性;
B.质子数相同,中子数不同的原子互称同位素;
C.汽油的主要成分是含碳原子5~11个的烃,烃为碳氢化合物,高温富氧环境造成氮的氧化物,与汽油不完全燃烧无关;
D.酸雨中亚硫酸为弱电解质,具有还原性,能被氧化成强电解质硫酸,溶液的PH减小.
解答 解:A.晶体硅具有导电性,可用于制造太阳能光电池,故A正确;
B.碘-131(${\;}_{53}^{131}$I)、铯-137(${\;}_{55}^{137}$Cs)是质子数不同,中子数不同的原子,不是同位素,故B错误;
C.机动车在行驶中烃类不完全燃烧,产生一氧化碳甚至冒黑烟,汽车尾气排放的氮氧化物是在汽车发动机气缸内高温富氧环境下氮气和氧气的反应,不是汽油不完全燃烧造成的,故C错误;
D.饱和CO2溶液的PH等于5.6,而雨水的pH由4.68变为4.28,是由于2H2SO3+O2═2H2SO4,溶液的酸性增强,PH减小,故D错误.
故选A.
点评 本题考查了硅的用途、同位素、汽车尾气中氮氧化物的形成以及酸雨等知识,题目难度不大,注意把握概念的内涵,注意酸雨的成因.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
14.下列化学用语正确的是( )
| A. | Na-O-H与 都表示氢氧化钠 都表示氢氧化钠 | B. |  与 与 都表示氟离子 都表示氟离子 | ||
| C. | -OH与 都表示羟基 都表示羟基 | D. |  与 与 都表示水分子 都表示水分子 |
12.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A、E单质常温下呈气态,B原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,D是地壳中含量最多的金属元素.有关上述元素的下列说法,正确的是( )
| A. | B的单质在自然界只有一种核素 | |
| B. | E的单质与任何物质反应,都只表现氧化性 | |
| C. | 元素C、D、E的原子中,原子半径依次减小 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
9. 兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
 兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )
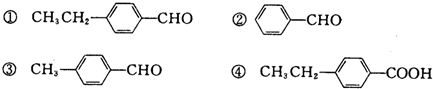
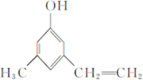
兴奋剂是体育比赛中禁用的药物,曾获得2013年欧洲冬季锦标赛4×400米接力银牌的俄罗斯运动员科特尔雅洛娃,近日被查出使用含有兴奋剂成分的药物.有一种兴奋剂的结构如图.关于它的说法中不正确的是( )| A. | 该有机物能发生酯化反应 | |
| B. | 该有机物属于芳香烃 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1 mol 该物质最多跟5mol氢气发生反应 |
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 30 g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4 L N2和CO2混合气体所含的分子数为2NA | |
| C. | 1 L浓度为1 mol•L-1的 H2O2水溶液中含有的氧原子数为2NA | |
| D. | MnO2和浓盐酸反应生成1 mol氯气时,转移的电子数为2NA |
13.下列实验操作能达到目的是( )
| A. | 加热氯化铵固体制取氨气 | |
| B. | 检验乙醇中是否含水:用无水硫酸铜,观察是否变蓝色 | |
| C. | 除去乙醛中的乙酸杂质:加入氢氧化钠溶液洗涤,分液 | |
| D. | 滴有酚酞的碳酸钠中,加入氯化钡溶液后,红色变浅,证明碳酸钠溶液中存在水解平衡 |
1.分子式为C5H12O的所有醇中,被氧化后可产生饱和一元醛最多有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
 .
. 化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答:
化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示.据图回答: