题目内容
16.设NA代表阿伏加德罗常数,下列说法不正确的是( )| A. | 3.55g氯气由分子变为氯离子时,得到的电子数为0.1NA | |
| B. | 20g重水(D2O)所含的电子数为10NA | |
| C. | 22.4L氮气所含的原子数为2NA | |
| D. | 常温下,1mol氩气所含的原子数为NA |
分析 A.氯气可以作氧化剂被氧化为氯离子,也可以是氯气自身氧化还原反应;
B.D2O中含有10个电子,摩尔质量是20g/mol;
C.未说明气体状况;
D.氩气为单原子分子.
解答 解:A.3.55gC12物质的量为0.05mol,变为氯离子时,氯气可以作氧化剂被还原为氯离子,也可以是氯气自身氧化还原反应;得到的电子数不一定为0.1NA个,故A错误;
B.20g重水(D2O)的物质的量是1mol,D2O分子中含有10个电子,含有的电子数为10NA,故B正确;
C.未说明气体状况,不能使用Vm=22.4L/mol,故C错误;
D.常温下,1mol氩气所含的原子数为NA,故D正确;
故选:AC.
点评 本题考查了阿伏伽德罗常数的分析判断,主要是物质的量和物理量的计算,气体摩尔体积的条件应用,注意氯气在氧化还原反应中表现的性质,注意稀有气体为单原子分子,题目难度不大.

练习册系列答案
相关题目
2.设NA为阿伏加德罗常数,下列说法中正确的是( )
| A. | 17g氨气中所含原子数为NA | |
| B. | 2NA个二氧化碳分子的质量为44g | |
| C. | 2.4g金属镁与足量盐酸完全反应,失电子总数为0.2NA | |
| D. | 0.1mol/LNaCl溶液中,Na+与Cl-离子总数为0.2NA |
4.1-丙醇蒸气与空气混合通过加热的铜网,生成一种化合物,与该化合物互为同分异构体的是( )
①CH3CH2OCH3
②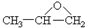
③CH3OOCCH3
④CH3COCH3
⑤CH3CHOHCH3.
①CH3CH2OCH3
②

③CH3OOCCH3
④CH3COCH3
⑤CH3CHOHCH3.
| A. | ①③ | B. | ①⑤ | C. | ②④ | D. | ①④ |
1.元素性质呈现周期性变化的本质原因是( )
| A. | 相对原子质量逐渐增大 | B. | 原子核外电子排布呈现周期性变化 | ||
| C. | 核电荷数逐渐增大 | D. | 元素的化合价呈现周期性变化 |
8.某有机物是甲酸和乙醇反应后生成物的同分异构体,此有机物是( )
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 乙二酸 | D. | 丁酸 |
5.卤代烃能够发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr.下列有机物可合成环丙烷的是( )
| A. | CH3CH2CH2Cl | B. | CH3CHBrCH2Br | C. | CH2BrCH2CH2Br | D. | CH3CHBrCH2CH2Br |
