题目内容
14.表为元素周期表的一部分,请回答有关问题:| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
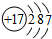
(2)表中非金属性最强的元素是F(填写元素符号)
(3)比较③和②的离子半径F->Mg2+(用元素符号表示)
(4)比较⑥和⑦的最高价氧化物的水化物的酸性强弱HClO4>H2SO4(用化学式表示)
(5)表中①到⑩有一种元素可以形成两性氢氧化物,写出该元素的氧化物与⑨的最高价氧化物的水化物反应的离子化学方程式:Al2O3+2OH-=2AlO2-+H2O.
分析 由元素在周期表的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)S位于第三周期第VIA族,Cl的原子结构中有3个电子层,最外层电子数为7;
(2)周期表中F的非金属性最强;
(3)③和②的离子具有相同电子层结构,原子序数大的离子半径小;
(4)非金属性越强,最高价氧化物的水化物的酸性越强;
(5)氧化铝具有两性,与KOH反应生成偏铝酸钾和水.
解答 解:由元素在周期表的位置可知,①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br,
(1)S位于第三周期第VIA族,Cl的原子结构中有3个电子层,最外层电子数为7,原子结构示意图为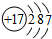 ,
,
故答案为:第三周期第VIA族;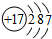 ;
;
(2)周期表中F的非金属性最强,故答案为:F;
(3)③和②的离子具有相同电子层结构,原子序数大的离子半径小,离子半径为F->Mg2+,故答案为:F->Mg2+;
(4)非金属性越强,最高价氧化物的水化物的酸性越强,酸性为HClO4>H2SO4,故答案为:HClO4>H2SO4;
(5)氧化铝具有两性,与KOH反应生成偏铝酸钾和水,离子反应为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质及元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列叙述中不正确的是( )
| A. | 卤化氢分子中,卤素的非金属性越强,共价键的极性也越强,稳定性也越强 | |
| B. | 以极性键结合的分子,不一定是极性分子 | |
| C. | 判断A2B或AB2型分子为极性分子必须知道该分子的空间构型 | |
| D. | 非极性分子中,各原子间都应以非极性键结合 |
4.已知:CO2+NaOH(少量)=NaHCO3,CO2+2Na0H(过量)=Na2CO3+H2O,现用含0.2molNaOH的溶液吸收一定量的CO2,将所得熔液低温蒸干得到固体甲(该温度下NaHCO3不分解).下列说法正确的是( )
| A. | 固体甲一定是Na2CO3 | |
| B. | 固体甲一定是NaHCO3 | |
| C. | 当吸收0.15molCO2时,所得固体甲中Na2CO3和NaHCO3物质的量相等 | |
| D. | 在固体甲中加入足量稀盐酸,充分反应后蒸干所得溶液,得到11.7gNaCl |
2.在标准状况下进行甲、乙、丙三组实验,三组各取30mL同浓度的盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
(1)甲组实验中,盐酸过量 (填“过量”“适量”或“不足量”),乙组实验中,盐酸不足量(填“过量”“适量”或“不足量”).参考合适的数据计算出盐酸的物质的量浓度为1mol/L.
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(mg) | 255 | 385 | 459 |
| 生成气体体积(mL) | 280 | 336 | 336 |
(2)参考合适的数据组合求得的Mg、Al的物质的量之比为1:1.
(3)在丙组实验之后,向容器中加入1mol•L-1的氢氧化钠溶液,能使合金中的铝恰好溶解,不形成含铝的沉淀,并使Mg2+刚好沉淀完全,再过滤出不溶固体,求滤液中各溶质的物质的量和所加入氢氧化钠溶液的体积.
9.关于卤素的下列叙述中正确的是( )
| A. | 卤素是典型的非金属元素,不能与其他非金属元素化合 | |
| B. | 卤素单质越活泼,其溶沸点就越低 | |
| C. | 卤素各单质都能和水剧烈反应 | |
| D. | 卤素气态氢化物的稳定性越强,还原性也越强 |
6. 以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
 以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
以NaBH4(B元素的化合价为+3价)和H2O2作原料的新型燃料电池,可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )| A. | a极上的电极反应式为:BH4-+8OH--8e-=BO2-+6H2O | |
| B. | 放电过程中,b电极附近溶液的pH减小 | |
| C. | 电池工作时,Na+从b极区移向a极区 | |
| D. | 若用该电池电解饱和食盐水,转移2 mole-时,阴极析出46gNa |
3.下列有关化学实验的叙述中,不正确的是( )
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 | |
| C. | 制备乙酸乙酯时,为除去乙酸乙酯中的乙酸,用氢氧化钠溶液收集产物 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
4. 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
(1)②、⑦、⑧三种元素最高价氧化物对应水化物的酸性由强到弱的顺序是HClO4>H2SO4>H2CO3(用化学式表示).
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素若是同一主族,任写一个符合条件的反应a的化学方程式:2Na+2H2O=2NaOH+H2↑或2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
单质乙与单质丙所含元素若是相邻主族,任写一个符合条件的反应a的化学方程式Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+H2↑.
 有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.
有①~⑧八种短周期元素,其原子序数依次增大,其中②、⑦、⑧三种元素在周期表中的相对位置如下,且元素②所处主族的位置为所有主族的正中间.| ② | |||
| ⑦ | ⑧ |
(2)如图所示,甲、乙、丙、丁均为①~⑧中某些元素形成的单质或化合物,反应a为置换反应,反应b为化合反应(反应条件已略去),单质乙与单质丙所含元素若是同一主族,任写一个符合条件的反应a的化学方程式:2Na+2H2O=2NaOH+H2↑或2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
单质乙与单质丙所含元素若是相邻主族,任写一个符合条件的反应a的化学方程式Mg+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$ Mg(OH)2+H2↑.
