题目内容
元素的分区和族
(1)s 区:ns1-2,包括 ;
(2)p区:ns2np1-6,最后的电子填在 上,包括 族元素,为非金属和少数金属;
(3)d区:(n-1)d1-6ns1-2,最后的电子填在 上,包括 族元素,为过渡金属;
(4)ds区:(n-1)d10ns1-2,(n-1)d全充满,最后的电子填在 上,包括 ,过渡金属(d和ds区金属合起来,为过渡金属).
(1)s 区:ns1-2,包括
(2)p区:ns2np1-6,最后的电子填在
(3)d区:(n-1)d1-6ns1-2,最后的电子填在
(4)ds区:(n-1)d10ns1-2,(n-1)d全充满,最后的电子填在
考点:元素周期表的结构及其应用,原子核外电子排布
专题:元素周期律与元素周期表专题
分析:(1)最后填充s电子,为s区元素;
(2)最后填充p电子,为p区元素,主要为主族和0族元素;
(3)最后填充d电子,为d区元素;
(4)(n-1)d全充满,最后的电子填s轨道,为ds区元素.
(2)最后填充p电子,为p区元素,主要为主族和0族元素;
(3)最后填充d电子,为d区元素;
(4)(n-1)d全充满,最后的电子填s轨道,为ds区元素.
解答:
解:(1)最后填充s电子,为s区元素,包括ⅠA、ⅡA及He元素,故答案为:ⅠA、ⅡA及He;
(2)最后填充p轨道电子,为p区元素,主要为主族和0族元素,包括ⅢA~ⅤⅡA元素及0族元素(He除外),故答案为:p轨道;ⅢA~ⅤⅡA元素及0族元素(He除外);
(3)最后填充d轨道电子,为d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素,故答案为:d轨道;ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外);
(4)(n-1)d全充满,最后的电子填在s轨道上,为ds区元素,包括ⅠB、ⅡB元素,为过渡金属,故答案为:s轨道;ⅠB、ⅡB.
(2)最后填充p轨道电子,为p区元素,主要为主族和0族元素,包括ⅢA~ⅤⅡA元素及0族元素(He除外),故答案为:p轨道;ⅢA~ⅤⅡA元素及0族元素(He除外);
(3)最后填充d轨道电子,为d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素,故答案为:d轨道;ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外);
(4)(n-1)d全充满,最后的电子填在s轨道上,为ds区元素,包括ⅠB、ⅡB元素,为过渡金属,故答案为:s轨道;ⅠB、ⅡB.
点评:本题考查原子的电子排布及区的划分,为高频考点,把握最后填充的电子为解答的关键,注意d区、ds区为过渡金属元素,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关FeCl3溶液和Fe(OH)3胶体叙述正确的是( )
| A、向FeCl3溶液和Fe(OH)3胶体中加入饱和NaCl溶液都不产生沉淀 |
| B、用滤纸过滤分离FeCl3溶液和Fe(OH)3胶体的混合物 |
| C、FeCl3饱和溶液与NaOH浓溶液混合即可制备得到Fe(OH)3胶体 |
| D、向Fe(OH)3胶体中逐滴滴入盐酸先产生沉淀,后沉淀溶解 |
设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A、1mol NH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为2NA |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1L 0.1mol/L NaCl溶液中所含的Na+为NA |
下列叙述正确的是( )
| A、P4和CO2分子中都只含有共价键 |
| B、CCl4和NH3的分子的立体结构都是正四面体形 |
| C、BF3分子中各原子均达到8e-稳定结构 |
D、甲烷的结构式为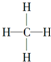 ,它是对称的平面形分子 ,它是对称的平面形分子 |
在18℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是( )
| A、多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B、多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C、多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D、多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |