题目内容
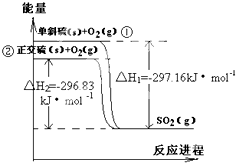 单斜硫和正交硫转化为二氧化硫的 能量变化图如图,回答下列问题:
单斜硫和正交硫转化为二氧化硫的 能量变化图如图,回答下列问题:(1)正交硫的稳定性比单斜硫
(2)写出单斜硫转化为正交硫的热化学方程式:
考点:反应热和焓变,热化学方程式
专题:化学反应中的能量变化
分析:(1)物质的能量越高越不稳定;硫与氧气生成SO2的反应为可逆反应;
(2)根据盖斯定律结合单斜硫和正交硫的燃烧方程式分析.
(2)根据盖斯定律结合单斜硫和正交硫的燃烧方程式分析.
解答:
解:(1)由图象可以看出,单斜硫的能量比正交硫的能量高,物质的能量越高越不稳定,所以正交硫的稳定性比单斜硫好;硫与氧气生成SO2的反应为可逆反应,则断裂lmol单斜硫和lmol O2中的共价键所吸收的能量比形成1mol SO2中的共价键所放出的能量少于297.16kJ;
故答案为:好;少;
(2)由图象可知:①S(s,单斜硫)+O2(g)=SO2(g)△H=-297.16kJ?mol -1,
②S(s,正交硫)+O2(g)=SO2(g)△H=-296.83kJ?mol -1,
由盖斯定律:方程式①-②得S(s,单斜硫)=S(s,正交硫)△H=-0.33kJ?mol -1,
故答案为:S(s,单斜硫)=S(s,正交硫)△H=-0.33kJ?mol -1.
故答案为:好;少;
(2)由图象可知:①S(s,单斜硫)+O2(g)=SO2(g)△H=-297.16kJ?mol -1,
②S(s,正交硫)+O2(g)=SO2(g)△H=-296.83kJ?mol -1,
由盖斯定律:方程式①-②得S(s,单斜硫)=S(s,正交硫)△H=-0.33kJ?mol -1,
故答案为:S(s,单斜硫)=S(s,正交硫)△H=-0.33kJ?mol -1.
点评:本题考查了化学反应与能量、热化学方程式的书写、物质稳定性的判断,题目难度不大,注意对基础知识的归纳整理.

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目
某化学反应的△H=+122kJ?mol-1,△S=-231J?mol-1?K-1,则此反应在下列哪种情况下可自发进行( )
| A、在任何温度下都能自发进行 |
| B、在任何温度下都不能自发进行 |
| C、仅在高温下自发进行 |
| D、仅在低温下自发进行 |
下列说法中正确的是( )
| A、化学反应中的能量变化都表现为热量变化 |
| B、△H的大小与热化学方程式的计量数无关 |
| C、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
| D、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
在以下性质的比较中,正确的是( )
| A、微粒半径:O2-<F-<Na+<K+ |
| B、共价键的键能:C-C>C-Si>Si-Si |
| C、分子中的键角:CH4>H2O>CO2 |
| D、共价键的键长:H-F>H-C1>H-Br>H-I |
 某有机物A的结构简式为如图,试回答:
某有机物A的结构简式为如图,试回答: