题目内容
在以下性质的比较中,正确的是( )
| A、微粒半径:O2-<F-<Na+<K+ |
| B、共价键的键能:C-C>C-Si>Si-Si |
| C、分子中的键角:CH4>H2O>CO2 |
| D、共价键的键长:H-F>H-C1>H-Br>H-I |
考点:微粒半径大小的比较,键能、键长、键角及其应用
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A.电子层数越大,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
B.原子半径越小,共价键键能越大;
C.根据分子的空间结构分析;
D.原子半径越大,共价键键长越大.
B.原子半径越小,共价键键能越大;
C.根据分子的空间结构分析;
D.原子半径越大,共价键键长越大.
解答:
解:A.电子层数越大,半径越大,K+具有三个电子层,半径最大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径:K+>O2->F->Na+,故A错误;
B.原子半径越小,共价键键能越大,原子半径:C<Si,则共价键的键能:C-C>C-Si>Si-Si,故B正确;
C.CH4为正四面体,键角为109°28′,H2O为V形,键角为105°,CO2为直线形,键角为180°,则分子中的键角:CO2>CH4>H2O,故C错误;
D.原子半径越大,共价键键长越大,原子半径:F<Cl<Br<I,则共价键的键长:H-F<H-C1<H-Br<H-I,故D错误.
故选B.
B.原子半径越小,共价键键能越大,原子半径:C<Si,则共价键的键能:C-C>C-Si>Si-Si,故B正确;
C.CH4为正四面体,键角为109°28′,H2O为V形,键角为105°,CO2为直线形,键角为180°,则分子中的键角:CO2>CH4>H2O,故C错误;
D.原子半径越大,共价键键长越大,原子半径:F<Cl<Br<I,则共价键的键长:H-F<H-C1<H-Br<H-I,故D错误.
故选B.
点评:本题考查微粒性质的比较,涉及离子半径、键能、键角、键长的比较等,涉及知识点较多,注重高频考点的考查,注意归纳规律性知识,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
下列物质能发生催化氧化且产物是2甲基丁醛的是( )
A、 |
B、 |
C、 |
D、 |
金属钠久置于空气中,最后变为( )
| A、Na2O |
| B、Na2CO3 |
| C、NaOH |
| D、Na2CO3?10H2O |
向纯水中加入少量NaHSO4晶体,若温度不变,则溶液中( )
| A、水电离出的H+大于水电离出的OH-浓度 |
| B、c(H+).c(OH-)乘积增大 |
| C、酸性增强 |
| D、H+,OH-浓度均增大 |
肯定不会影响化学平衡的因素是( )
| A、温度 | B、浓度 | C、压强 | D、催化剂 |
有机化合物与人类生活水平的提高和人类社会的发展密不可分.下列对有机化合物的认识正确的是( )
| A、碳原子的成键方式多是有机物种类繁多原因之一 |
| B、有机化合物都含有碳、氢元素 |
| C、有机化合物都具有同分异构现象 |
| D、有机化合物都具有可燃性 |
下列反应不属于置换反应的是( )
| A、CuO+H2=Cu+H2O |
| B、C+2CuO=2Cu+CO2↑ |
| C、Fe2O3+3CO=2Fe+3CO2 |
| D、Fe+CuCl2=Cu+FeCl2 |
下列有关热化学方程式的叙述正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ |
| B、已知C(石墨,s)═C(金刚石,s);△H>0,则金刚石比石墨稳定 |
| C、己知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2则△H1>△H2 |
| D、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol |
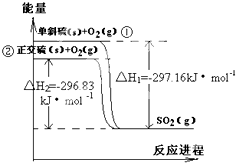 单斜硫和正交硫转化为二氧化硫的 能量变化图如图,回答下列问题:
单斜硫和正交硫转化为二氧化硫的 能量变化图如图,回答下列问题: