题目内容
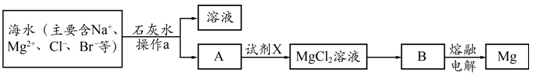
10.化学反应一定伴随着能量变化,下列反应的能量变化与如图相符的是( )
| A. | 高温煅烧石灰石 | |
| B. | 氧化钙与水反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
分析 由图可知反应物总能量大于生成物总能量,则为放热反应,
①放热反应:有热量放出的化学反应,因为反应物具有的总能量高于生成物具有的总能量.常见放热反应:燃烧与缓慢氧化,中和反应;金属与酸反应制取氢气,生石灰和水反应等.
②吸热反应:有热量吸收的化学反应,因为反应物具有的总能量低于生成物具有的总能量.常见的吸热反应:C(s)+H2O(g)→CO(g)+H2O; C+CO2→CO的反应,以及KClO3、KMnO4、CaCO3的分解等,以此解答该题.
解答 解:A.高温煅烧石灰石,为吸热反应,故A不选;
B.氧化钙与水反应放出大量的热,为放热反应,故B选;
C.氢气还原氧化铜为吸热反应,故C不选;
D.Ba(OH)2•8H2O晶体与NH4Cl固体的反应为吸热反应,故D不选.
故选B.
点评 本题考查化学反应的热量变化,为高频考点,侧重考查学生的双基知识,难度不大,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
1.铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法不正确的是( )
铝土矿$→_{①}^{过量NaOH}$a $→_{②}^{过量盐酸}$b$\stackrel{③}{→}$c$\stackrel{④}{→}$d$\stackrel{电解}{→}$Al.
铝土矿$→_{①}^{过量NaOH}$a $→_{②}^{过量盐酸}$b$\stackrel{③}{→}$c$\stackrel{④}{→}$d$\stackrel{电解}{→}$Al.
| A. | b中铝元素是以阳离子形式存在 | |
| B. | ①、②中除加试剂外,还需要进行过滤操作 | |
| C. | ④进行的操作是加热,而且d一定是氧化铝 | |
| D. | ③中需要通入过量的二氧化碳 |
18.下列金属与水反应最剧烈的是( )
| A. | 锂 | B. | 钠 | C. | 钾 | D. | 铷 |
4. 在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
 在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )
在t℃时,Ag2CrO4(橘红色) 在水溶液中沉淀溶解平衡曲线如图所示.又知AgCl的Ksp=1.8×10-10.下列说法正确的是( )| A. | 将AgNO3溶液滴加到KCl溶液中,反应的活化能几乎为零 | |
| B. | t℃时,Ag2CrO4的Ksp=1×10-8 | |
| C. | 饱和Ag2CrO4溶液中,加入水能使溶液由X点变为Y点 | |
| D. | t℃时,AgCl比Ag2CrO4的溶解度大 |
1.一定温度下,将 2mol SO2 和 1mol O2充入2L密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)?2SO3(g);△H=-197kJ•mol-1,下列说法中正确的是( )
| A. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率 | |
| B. | 达到反应限度时,反应放出197kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | SO2和SO3物质的量之和一定为2mol |
2.下列化学用语正确的是( )
| A. | H2S的电子式: | B. | S2-结构示意图: | C. | Na2O2的电子式: | D. | CCl4的电子式: |


 .
. .
.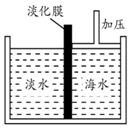 海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.
海水中含有丰富的Na+、Mg2+、Cl-、Br-等化学资源.将海水淡化与浓缩海水结合是综合利用海水资源的途径之一.以浓缩海水为原料,通过一系列工艺流程可以提取Mg、Br2等产品.