题目内容
18.下列说法正确的是( )| A. | 二氧化碳通过Na2O2粉末后固体物质质量增加 | |
| B. | 在NaClO溶液中,H+、NH4+、SO42-、Br-可以大量共存 | |
| C. | Na2S溶液在空气中长期放置变浑浊的离子方程式为2S2-+O2+4H+=2S↓+2H2O | |
| D. | NH4HCO3溶液中滴加足量NaOH溶液的离子方程式为HCO3-+OH-=CO32-+H2O |
分析 A.依据方程式:2CO2+2Na2O2=2Na2CO3+O2,判断;
B.次氯酸根离子与氢离子反应生成次氯酸;
C.Na2S在空气中长期放置变浑浊,是硫离子的还原性被空气中的氧气氧化生成硫单质;
D.漏掉铵根离子与氢氧根离子的反应.
解答 解:A.依据方程式:2CO2+2Na2O2=2Na2CO3+O2,通入88g二氧化碳,放出32g氧气,所以固体物质质量增加,故A正确;
B.在NaClO溶液中,氢离子不能大量共存,故B错误;
C.Na2S在空气中长期放置变浑浊,是硫离子的还原性被空气中的氧气氧化生成硫单质,2S2-+O2+2H2O=2S+4OH-,故C错误;
D.NH4HCO3溶液中滴加足量NaOH溶液的离子方程式为:NH4++OH-+HCO3-+OH-=CO32-+H2O+NH3•H2O,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
9.T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数φ(Y)与时间的关系如图2所示.则下列结论错误的是( )
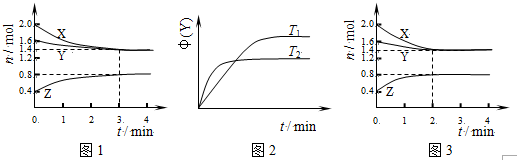

| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | 保持其他条件不变,升高温度,反应的化学平衡常数K减小 | |
| D. | 其它条件不变,使用催化剂,则反应进程可能如图3所示 |
6.推理在问题解决过程中常涉及到.同学们要学会从实验数据、物质已知的性质、题给信息等各种渠道收集证据,对物质的性质及其变化提出可能的假设;基于这些证据进行分析推理,最后形成科学结论.
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
(1)实验①和实验④得出的结论
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
(一) 有无色溶液,可能含有K+、SO42-、CO32-、NH4+、Cl-、Ba2+、Cu2+中的一种或几种,按以下步骤进行实验:
①取100ml溶液往其中加入足量稀硫酸,有0.224L(标况下)气体产生;
②另取100ml溶液滴加足量Ba(NO3)2溶液,有4.2g白色沉淀生成
③继续向②中的溶液滴加足量NaOH溶液并加热,产生刺激性气味的气体0.672L(标况下);
根据以上事实判断:
(1)肯定存在的是CO32-、SO42-、NH4+、K+;
(2)肯定不存在的是Cu2+,Ba2+;
(3)不能确定是否存在的是Cl-.请简述证明该物质是否存在的实验方案(实验方法、现象、结论)将②所得混合物过滤,向滤液中加入硝酸酸化的硝酸银,若产生白色沉淀,证明原溶液中含有氯离子,否则不含氯离子
(二).某学习小组设计以下四个实验探究氯水的成分,请根据表回答问题.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到紫色石蕊试液中 | 氯水中不仅有H+还有HClO | |
| ③ | 将氯水滴加到淀粉-KI试纸上 | 淀粉-KI试纸变蓝 (I2遇淀粉变蓝) | 氯水中有Cl2 |
| ④ | 将足量的氯水滴加到NaHCO3溶液中 | 有气泡生成 |
①氯水中含有Cl-,④氯水中含有H+.
(2)指出实验②中的“实验现象”为紫色石蕊先变红后褪色.
(3)实验③中的离子反应方程式Cl2+2I-=2Cl-+I2.
13.“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料,如将“纳米材料”分散到液体分散剂中,所得混合物属于下列分散系中的( )
| A. | 溶液 | B. | 悬浊液 | C. | 乳浊液 | D. | 胶体 |
3.下列关于分散系的叙述不正确的是( )
| A. | 分散系的分类: | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 如图显示的是树林的晨曦,该现象与丁达尔效应有关 | |
| D. | 在Fe(OH)3胶体中加入过量硫酸后会出现红褐色沉淀 |
10.某探究小组在某温度下,测得溶液的PH时发现:0.01mol•L-1的NaHSO4溶液中,由水电离出的 C(H+)•C(OH-)=10-20.在该温度下,将V1 L PH=4的NaHSO4溶液与V2L PH=9的Ba(OH)2溶液混合(忽略溶液体积变化),所得溶液PH=7,则V1:V2等于( )
| A. | 9:1 | B. | 10:1 | C. | 1:10 | D. | 9:2 |
7.下列反应中,属于氧化还原反应的是( )
| A. | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3•H2O | |
| B. | 2NO2+2OH-=NO3-+NO2-+H2O | |
| C. | SnCl4+2H2O=SnO2+4HCl | |
| D. | CO32-+CO2+H2O=2HCO3- |
5.(1)应用氨厂生产的氨气,侯德榜设计了侯氏制碱法,其生产流程如下:
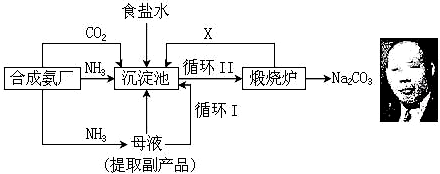
①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
⑤反应温度需要控制在30-35℃,原因是温度高于35℃时碳酸氢铵受热分解剧烈,温度低于30℃又减慢了化学反应的速率;
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.

①工业合成氨时,通常采用以铁为主的催化剂,在温度为℃和压强为400~500、10~30MPa的条件下合成.
②沉淀池中发生反应的化学方程式NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓.
③上述流程中可循环利用的物质为NH3、CO2(填化学式),副产品为NH4Cl(填化学式).
④与氨碱法生产纯碱比较,侯氏制碱法有什么优点?综合利用原料(氯化钠的利用率提高到了96%)、降低成本、减少环境污染.
(2)实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度(g/100g水)表
温度 盐 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
为控制此温度范围,通常采取的加热方法为水浴加热.
⑥保温30分钟,静置后只析出NaHCO3晶体的原因相同温度下,碳酸氢钠的溶解度小.