题目内容
1.用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的是( )| 实验目的 | 实验方案 | 所选玻璃仪器 | |
| A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
| B | 证明HClO和CH3COOH的酸性强弱 | 同温下用pH试纸测定浓度为0.1mol•L-1NaClO溶液和0.1mol•L-1CH3COONa溶液的pH | 玻璃棒、玻璃片 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
| D | 配制1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL) | 将25g CuSO4•5H2O溶解在975水中 | 烧杯、量筒、玻璃棒 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.过滤时还需要用漏斗;
B.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH;
C.银镜反应需要在碱性条件下进行;
D.1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)中溶质的物质的量是0.1mol.
解答 解:A.过滤时还需要用漏斗,该实验中没有漏斗,故A错误;
B.NaClO具有强氧化性,不能用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH,则不能确定pH大小,不能比较酸性的强弱,故B错误;
C.银镜反应需要在碱性条件下进行,所以在加入银氨溶液之前需要加入NaOH溶液中和未反应的酸,故C错误;
D.1L 1.6%的CuSO4溶液(溶液密度近似为1g/mL)中溶质的物质的量是0.1mol,溶液的质量是1000g,25g CuSO4•5H2O中硫酸铜的物质的量是0.1mol,故D正确;
故选D.
点评 本题考查了实验方案评价,明确实验原理是解本题关键,题目难度不大,注意不能用pH试纸检验次氯酸钠溶液的pH大小,因为次氯酸具有漂白性,易错选项是B.

练习册系列答案
相关题目
12.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| B. | 0.1mol/L的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8gNa2S和7.8gNa2O2中含有的阴离子 数目均为0.1NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不相同 |
9.下列叙述中说明某化学平衡一定发生移动的是( )
| A. | 混合体系中气体密度发生变化 | B. | 正、逆反应速率改变 | ||
| C. | 混合物中各组分的浓度改变 | D. | 反应物的转化率改变 |
6.化学与生产、生活密切相关.对下列现象或事实解释,不正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 开启啤酒瓶后会大量冒泡 | 压强减小,气体的溶解平衡向压强增大方向移动 |
| B | 废旧电池要集中回收处理 | 废旧电池中含有重金属离子,随意丢弃会污染环境 |
| C | 热碱水清除炊具上残留的油污 | Na2C03和油污可直接发生反应 |
| D | 工业上常用电解法冶炼Na、Mg | 电解池阴极有强还原性 |
| A. | A | B. | B | C. | C | D. | D |
13.下列关于Na2CO3溶液的说法,正确的是( )
| A. | 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 | |
| B. | 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 | |
| C. | VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2NA | |
| D. | CaC03在饱和Na2C03溶液中的KSP比在纯水中的KSP小 |
10.钢铁厂在冷轧过程中会产生高浓度酸性含铁废水,主要含有H+、Cl-、Fe2+、Fe3+等,其处理的主要工艺流程如下:
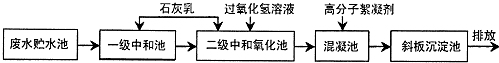
请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a腐蚀水利设施 b影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氧的主要作用是b(填字母).a还原剂 b氧化剂
(4)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌.液氯注入水中后,能杀死水中细菌的物质是HClO(填化学式).
(5)污水处理中的主要化学方法有中和法、混凝法_、_沉淀法_、氧化还原法.
(6)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
稀释后的溶液中c(Fe2+)=0.12mol/L.

请回答:
(1)废水未经处理直接排放的危害是ab(填字母).
a腐蚀水利设施 b影响水生生物的自然生长
(2)石灰乳用于中和含铁废水中的酸,写出石灰乳与盐酸反应的化学方程式:Ca(OH)2+2HCl═CaCl2+2H2O.
(3)过氧化氧的主要作用是b(填字母).a还原剂 b氧化剂
(4)自来水厂常用漂白粉、液氯、二氧化氯、臭氧等作为消毒剂,杀灭水中的细菌.液氯注入水中后,能杀死水中细菌的物质是HClO(填化学式).
(5)污水处理中的主要化学方法有中和法、混凝法_、_沉淀法_、氧化还原法.
(6)某研究小组对钢铁厂高浓度酸性含铁废水进行监测时,取其样本稀释,测得有关数据如下:
| 离子 | H+ | Cl- | Fe2+ | Fe3+ |
| 浓度(mol•L)-1 | 0.16 | 0.94 | 0.18 |
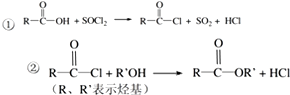
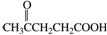 合成聚芳酯E的路线:
合成聚芳酯E的路线: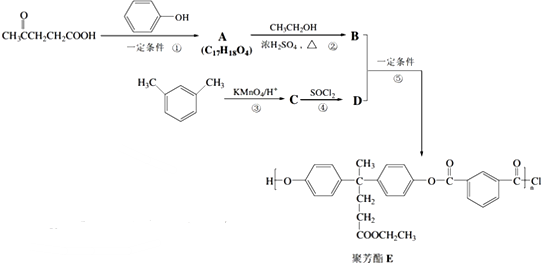
 .
. .
.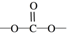 结构
结构 .
.