题目内容
如表为元素周期表的一部分:(填元素符号或化学式)
(1)写出元素④在周期表中的位置 .
(2)②、③、⑤的原子半径由大到小的顺序为 .
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是 .
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: .
(5)②、⑤对应的氢化物中沸点较高的是 ,其中②的氢化物中心原子杂化类型为 ,分子的空间构型是 .
(6)④、⑤、⑦三种元素第一电离能的大小顺序为 .
(7)画出②的核外电子排布图 .
| 族 周期 |
||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑦ | ⑤ | ⑥ | |||
(2)②、③、⑤的原子半径由大到小的顺序为
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
(5)②、⑤对应的氢化物中沸点较高的是
(6)④、⑤、⑦三种元素第一电离能的大小顺序为
(7)画出②的核外电子排布图
考点:位置结构性质的相互关系应用,元素周期表的结构及其应用,元素周期律的作用,元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表的位置可知,①②③④⑤⑥⑦分别为H、O、Na、Si、S、Cl、P,
(1)Si位于第三周期第ⅣA族;
(2)同周期原子序数大的半径小,同主族原子序数大的原子半径大;
(3)非金属性越强,气态氢化物越稳定;
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等;
(5)水中含氢键沸点高;水中O原子有2个孤对电子,成键数为2,分子为V型;
(5)Si、S、P中,3p电子半满为稳定结构,非金属强的第一电离能大;
(6)O的电子排布为1s22s22p2.
(1)Si位于第三周期第ⅣA族;
(2)同周期原子序数大的半径小,同主族原子序数大的原子半径大;
(3)非金属性越强,气态氢化物越稳定;
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等;
(5)水中含氢键沸点高;水中O原子有2个孤对电子,成键数为2,分子为V型;
(5)Si、S、P中,3p电子半满为稳定结构,非金属强的第一电离能大;
(6)O的电子排布为1s22s22p2.
解答:
解:由元素在周期表的位置可知,①②③④⑤⑥⑦分别为H、O、Na、Si、S、Cl、P,
(1)④为Si,Si位于第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)同周期原子序数大的半径小,同主族原子序数大的原子半径大,②、③、⑤的原子半径由大到小的顺序为Na>S>O,故答案为:Na>S>O;
(3)非金属性为Cl>S>Si,气态氢化物的稳定性为HCl>H2S>SiH4,故答案为:HCl>H2S>SiH4;
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等,NaOH的电子式为 ,
,
故答案为: ;
;
(5)水中含氢键,则H2O的沸点高,水中O原子有2个孤对电子,成键数为2,则O原子为sp3杂化,分子为V型,故答案为:H2O;sp3;
(5)Si、S、P中,3p电子半满为稳定结构,非金属强的第一电离能大,第一电离能为P>S>Si,
故答案为:P>S>Si;
(6)O的电子排布为1s22s22p2,核外电子排布图为 ,
,
故答案为: .
.
(1)④为Si,Si位于第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(2)同周期原子序数大的半径小,同主族原子序数大的原子半径大,②、③、⑤的原子半径由大到小的顺序为Na>S>O,故答案为:Na>S>O;
(3)非金属性为Cl>S>Si,气态氢化物的稳定性为HCl>H2S>SiH4,故答案为:HCl>H2S>SiH4;
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,如NaOH、NaClO等,NaOH的电子式为
 ,
,故答案为:
 ;
;(5)水中含氢键,则H2O的沸点高,水中O原子有2个孤对电子,成键数为2,则O原子为sp3杂化,分子为V型,故答案为:H2O;sp3;
(5)Si、S、P中,3p电子半满为稳定结构,非金属强的第一电离能大,第一电离能为P>S>Si,
故答案为:P>S>Si;
(6)O的电子排布为1s22s22p2,核外电子排布图为
 ,
,故答案为:
 .
.
点评:本题考查位置、结构及性质的综合应用,为高频考点,把握元素的位置、元素化合物性质及原子结构与性质等为解答的关键,侧重原子结构与性质及化学用语的考查,题目难度中等.

练习册系列答案
相关题目
下列说法错误的是( )
| A、0.012kg 12C含有的12C是NA个 |
| B、NA个水分子的质量是18g/mol |
| C、1mol O2中含有的氧气分子数为NA个 |
| D、含有NA个氧原子的H2SO4的物质的量是0.25mol |
已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)下列说法不正确的是( )
| A、增大压强正反应速率增大,逆反应速率减小,平衡右移 |
| B、使用高效催化剂可有效提高正反应速率 |
| C、反应达到平衡后,N0的反应速率保持恒定 |
| D、单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
下列各组离子,在指定的环境中可能大量共存的是( )
| A、水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ |
| B、滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3- |
| C、与金属铝反应只能放出氢气的溶液:NO3-、K+、Cl-、Na+、OH- |
| D、c(H+)>c(OH-)的溶液中:Na+、K+、SO42-、S2- |
铋(Bi)最高化合价为+5价,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色.现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:
则NaBiO3、KMnO4、I2、H2O2的氧化性由强到弱的顺序为( )
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
| A、NaBiO3、KMnO4、H2O2、I2 |
| B、KMnO4、NaBiO3、H2O2、I2 |
| C、I2、H2O2、KMnO4、NaBiO3 |
| D、KMnO4、NaBiO3、I2、H2O2 |
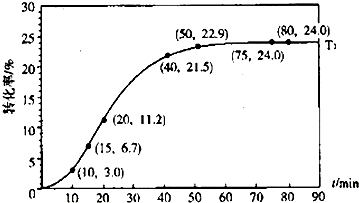
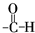
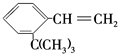 滴入溴水后生成产物的结构简式为
滴入溴水后生成产物的结构简式为