题目内容
19.Cl2可用于废水处理.向KCN溶液中先加入足量KOH溶液再通入氯气,充分反应后生成两种无毒的气体.下列说法正确的是( )| A. | 两种无毒的气体均为还原产物 | |
| B. | 反应后溶液的pH会升高 | |
| C. | 氧化剂与还原剂的物质的量之比为5:2 | |
| D. | 每转移2NA个电子时,一定会生成13.44 L的气体 |
分析 KCN+2KOH+Cl2=KOCN+2KCl+H2O;氰酸盐再进一步被液氯氧化为无毒气体,反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,由此分析解答.
解答 解:A.N元素化合价由-3价升高为0价,共升高6价,所以氮气是氧化产物,故A错误;
B.氢氧化钾生成氯化钾,碱性变成中性,所以溶液的pH会降低,故B错误;
C.由反应KCN+2KOH+Cl2=KOCN+2KCl+H2O,2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O可知氧化剂与还原剂的物质的量之比为5:2,故C正确;
D.状况不知,所以无法求气体的体积,故D错误;
故选C.
点评 本题综合考查学生的分析能力和计算能力,注意把握元素化合价的判断,为解答该题的关键,结合电子得失守恒解答该题,难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
9.由短周期元素组成的中学常见物质A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去),下列推断不正确的是( )
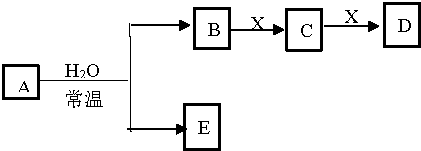

| A. | 若D是白色沉淀,D与A的摩尔质量相等,则X可能是铝盐 | |
| B. | 若X是Na2SO3,C是气体,则A可能是氯气,且D和E能发生反应 | |
| C. | 若D是CO,C能和E反应,则A是Na2O2,X的同素异形体只有3种 | |
| D. | 若A是单质,B和D的反应是,则E一定能还原Fe2O3 |
10.欲测定Mg(NO3)2•n H2O中结晶水的含量,下列方案中肯定不可行的是( )
| A. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 | |
| B. | 称量样品→加热→冷却→称量Mg(NO3)2 | |
| C. | 称量样品→加热→冷却→称量MgO | |
| D. | 称量样品→加NaOH溶液→过滤→加热→冷却→称量MgO |
14.能使氢硫酸溶液的pH先升高后降低的物质是( )
| A. | Cl2 | B. | SO2 | C. | CuSO4 | D. | O2 |
4.下列表示物质结构的化学用语或模型正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | HF的电子式: | ||
| C. | S2-的结构示意图: | D. | CCl4分子的比例模型: |
8.下列实验“操作和现象”与“结论”对应关系正确的是( )
| 操作和现象 | 结论 | |
| A | 常温下,将Al箔插入浓HNO3中,无明显现象 | 铝和浓硝酸不反应 |
| B | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| C | 用铂丝蘸取溶液进行焰色反应,观察到火焰呈黄色 | 该溶液一定是钠盐溶液 |
| D | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| A. | A | B. | B | C. | C | D. | D |
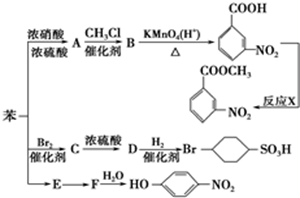
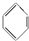 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,其反应类型为取代反应.
+H2O,其反应类型为取代反应.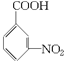 +CH3OH
+CH3OH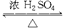
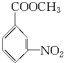 +H2O.
+H2O.