题目内容
下表是几种碳酸盐的分解温度和阳离子半径,分析下表可以得出( )
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
| A、离子晶体中阳离子的半径越大,越易分解 |
| B、离子晶体中阳离子的半径越小,越易分解 |
| C、离子晶体中阳离子的半径越大,结合碳酸根中的氧离子越容易 |
| D、离子晶体中阳离子的半径越小,结合碳酸根中的氧离子越容易 |
考点:用晶格能的大小衡量离子晶体中离子键的强弱
专题:化学键与晶体结构
分析:从表格中得出:这些物质的阴离子是相同的,均为碳酸根,阳离子的半径越大,分解温度越高,据此解答即可.
解答:
解:由于Mg2+、Ca2+、Sr2+、Ba2+为同主族元素的离子,从上到下,离子半径逐渐增大,半径越大,分解温度越高,越不易分解,相反,阳离子半径越小,越容易分解,故B正确,从表格中还可以得出:阳离子的半径越大,结合碳酸根中的氧离子越容易,故C正确,
故选BC.
故选BC.
点评:本题考查了离子晶体晶格能与熔点的关系,难度不大,准确掌握提给表格中的信息是解决本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质与其用途完全符合的有( )
①Al(OH)3-抗酸药 ②Si-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤NaClO-消毒剂 ⑥Al 和Fe2O3-焊接钢轨
⑦Fe2O3-红色油漆或涂料 ⑧MgO-耐火材料.
①Al(OH)3-抗酸药 ②Si-太阳能电池 ③AgI-人工降雨
④NaCl-制纯碱 ⑤NaClO-消毒剂 ⑥Al 和Fe2O3-焊接钢轨
⑦Fe2O3-红色油漆或涂料 ⑧MgO-耐火材料.
| A、5条 | B、6条 | C、7条 | D、8条 |
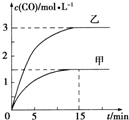 T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )
T℃下发生反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0.向甲、乙两个恒容密闭容器中加入一定量C和H2O,各容器的容积、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示:下列说法正确的是( )| 容器 | 甲 | 乙 |
| 容积 | 0.5L | V |
| 2molC 1molH2O | 4molC 2molH2O |
| A、甲容器中前15min反应的平均速率υ(H2)=0.2 mol?L-1?min-1 |
| B、乙容器的容积V=0.5 L |
| C、向甲容器加入少量C(s),平衡正向移动 |
| D、反应温度升高,平衡常数增大 |
门捷列夫在绘制元素周期表时许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素(与硅处于同族),后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确.根据元素周期律,下列有关X性质的描述中错误的是( )
| A、X单质不易与水反应 |
| B、XO2可被碳还原为X |
| C、XH4的稳定性比SiH4的高 |
| D、X的半径比Si的大 |
在相同条件下,下列气态氢化物的稳定性排列顺序正确的是( )
| A、HF>HCl>HBr>HI |
| B、HCl>HBr>HI>HF |
| C、HBr>HI>HF>HCl |
| D、HI>HBr>HCl>HF |
化学与生活密切相关,下列有关说法正确的是( )
| A、糖类、油脂、蛋白质属于天然高分子化合物 |
| B、维生素C具有还原性,在人体内起抗氧化作用 |
| C、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| D、制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
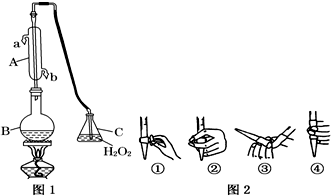
如图所示,图中四种装置工作一段时间后,测得导线上均通过了0.002mol电子,此时溶液的pH由小到大的排列顺序为(不考虑溶液的水解和溶液的体积变化)( )

| A、①<②<③<④ |
| B、②<①<③<④ |
| C、②<①<④<③ |
| D、①<②<④<③ |