题目内容
 利用生产钛白的副产品绿矾(FeSO4?7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3?nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:
利用生产钛白的副产品绿矾(FeSO4?7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3?nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉.涉及的主要反应有:FeCO3
| ||
| ||
| ||
(1)用稀硫酸代替水溶解绿矾的原因是
抑制Fe2+水解
抑制Fe2+水解
.(2)证明沉淀已经洗涤干净的方法是
取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净
取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净
.(3)干燥过程中少量FeCO3?nH2O被氧化为FeOOH,反应方程式为:
4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O
4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O
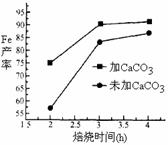
.(4)沉淀中仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,下图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图象分析,CaCO3的另一作用为
分解产生CO2与C反应生成还原剂CO
分解产生CO2与C反应生成还原剂CO
.分析:(1)硫酸亚铁易水解而使其溶液呈酸性,酸能抑制亚铁离子水解;
(2)FeCO3?nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀;
(3)FeCO3?nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳.
(2)FeCO3?nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀;
(3)FeCO3?nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳.
解答:解:(1)硫酸亚铁是强酸弱碱盐,易水解而使其溶液呈酸性,向溶液中加入酸能抑制亚铁离子水解,所以用稀硫酸代替水溶解绿矾,
故答案为:抑制Fe2+水解;
(2)FeCO3?nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀,如果沉淀已经洗涤干净,则其洗涤液中不含硫酸根离子,其检验方法是:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净,
故答案为:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净;
(3)FeCO3?nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水,反应方程式为:4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O,
故答案为:4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原铁粉的产率增大,
故答案为:分解产生CO2与C反应生成还原剂CO.
故答案为:抑制Fe2+水解;
(2)FeCO3?nH2O沉淀易吸收硫酸根离子,硫酸根离子能和钡离子反应生成白色沉淀,如果沉淀已经洗涤干净,则其洗涤液中不含硫酸根离子,其检验方法是:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净,
故答案为:取少量最后一次洗涤液于试管,滴入BaCl2溶液,若无白色沉淀产生,表明沉淀已洗涤干净;
(3)FeCO3?nH2O易被氧气氧化为FeOOH,同时生成二氧化碳和水,反应方程式为:4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O,
故答案为:4FeCO3?nH2O+O2=4FeOOH+4CO2↑+(4n-2)H2O;
(4)高温下,碳酸钙分解生成二氧化碳,二氧化碳能被碳还原生成一氧化碳,所以加入碳酸钙能增加一氧化碳的含量,则还原铁粉的产率增大,
故答案为:分解产生CO2与C反应生成还原剂CO.
点评:本题考查了实验方案的设计,明确物质的性质是解本题关键,会根据图象进行分析解答,难度中等.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目

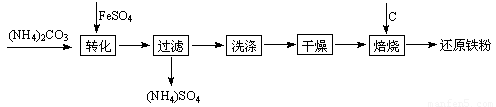
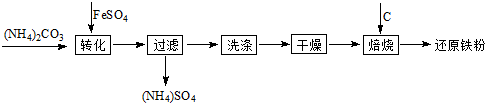
 (8分)利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:FeCO3
(8分)利用生产钛白的副产品绿矾(FeSO4•7H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3•nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:FeCO3