题目内容
16.芳香烃A的分子式为C7H8,已知它存在如下转化关系,其中C是一种一元醇,D是A的对位一溴取代物,H和E,I和F分别互为同分异构体;
(1)化合物I的结构简式是
 .反应B→C的化学方程式是
.反应B→C的化学方程式是 .
.(2)C(C7H8O)的含有苯环的同分异构体还有4种.
(3)为验证E→F的反应类型与E→G不同,下列实验方法切实可行的是C.
A.向E→F反应后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黄色沉淀
B.向E→F反应后的混合液中加入溴水,发现溴水褪色
C.向E→F反应后的混合液中加入盐酸酸化后,滴入溴的CCl4溶液,发现溶液褪色
D.E→F反应后的混合液中加入酸性KMnO4溶液,混合液紫红色变浅.
分析 分子式为C7H8的芳香烃一定是甲苯,即A的结构简式是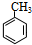 .在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是
.在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是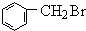 .卤代烃水解得到醇,故C是
.卤代烃水解得到醇,故C是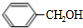 ,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为
,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为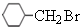 ,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为
,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为 .D是A的对位一取代物,则D的结构简式为:
.D是A的对位一取代物,则D的结构简式为: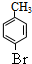 ,H与E,则D与氢气发生加成反应生成E为
,H与E,则D与氢气发生加成反应生成E为 ,I与F分别互为同分异构体,则E发生消去反应生成F为
,I与F分别互为同分异构体,则E发生消去反应生成F为 ,由G的分子式可知,E发生水解反应生成G,则G的结构简式为
,由G的分子式可知,E发生水解反应生成G,则G的结构简式为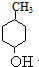 ,以此解答该题.
,以此解答该题.
解答 解:(1)由上述分析可知,化合物I的结构简式是 ,反应B→C的化学方程式是
,反应B→C的化学方程式是 ,
,
故答案为: ;
; ;
;
(2)C是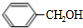 ,对应的同分异构体可为甲基苯酚,有邻、间、对3种,还可为醚(CH3-O-C6H5),则含有4种同分异构体,故答案为:4;
,对应的同分异构体可为甲基苯酚,有邻、间、对3种,还可为醚(CH3-O-C6H5),则含有4种同分异构体,故答案为:4;
(3)E→F是消去反应,E→G是水解反应,
A.消去反应、水解反应均有溴离子生成,故A错误;
B.因为混合液中含有氢氧化钠,因此加入溴水,溴水会和氢氧化钠反应颜色也会褪去,B错误;
C.反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,溶液褪色,说明消去反应生成碳碳双键,故C正确;
D.酸性高锰酸钾溶液也会氧化溴离子而褪色,故D错误,
故答案为:C.
点评 本题考查有机物推断,为高频考点,侧重考查学生的分析能力,判断A为甲苯,再充分根据有机物分子式进行推断,需要学生熟练掌握官能团的性质与转化,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
(1)哪一时间段(指①0~1、②1~2、③2~3、④3~4、⑤4~5min,下同)反应速率最大2~3 min (填序号,下同),原因是该反应是放热反应,此时温度升高.
(2)哪一段时段的反应速率最小4~5min,原因是盐酸的浓度减小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A..蒸馏水 B.KNO3溶液 C.NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号)AC.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标况下) | 50 | 120 | 232 | 290 | 310 |
(2)哪一段时段的反应速率最小4~5min,原因是盐酸的浓度减小.
(3)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变,不要求写出计算过程)0.1mol/(L•min).
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A..蒸馏水 B.KNO3溶液 C.NaCl溶液 D.CuSO4溶液
你认为可行的是(填编号)AC.
7.NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 46g14CO2含有的中子数为22NA | |
| B. | 标准状况下,22.4LCH3C1含有的分子数为NA | |
| C. | lmol甲醇中含有C-H键的数目为4NA | |
| D. | 6.8g液态KHSO4中含有0.1NA个阳离子 |
4.下列组合不能形成配位键的是( )
| A. | Ag+、NH3 | B. | H2O、H+ | C. | Co3+、CO | D. | Cu2+、H+ |
11.有十种物质:①甲烷; ②聚乙烯;③苯;④苯乙烯;⑤邻二甲苯;⑥环己烷;⑦环己烯;⑧聚乙炔;⑨乙醇;⑩2-丁炔.既能使酸性高锰酸钾溶液褪色,又能使溴水因化学反应褪色的共有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.某小组同学利用图所示装置进行铁的电化学腐蚀原理的探究实验:
(l)小组同学认为以上两种检验方法,均能证明铁发生了电化学腐蚀.
①实验i中的现象是碳棒附近溶液变红.
②用化学用语解释实验i中的现象:O2+2H2O+4e-═4OH-.
(2)查阅资料:K3[Fe(CN)6]具有氧化性.
①据此有同学认为仪通过ii中现象不能证明铁发生了电化学腐蚀,理由是铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验
②进行下列实验,在实验几分钟后的记录如表:
a.以上实验表明:在Cl-存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应.
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验III,发现铁片表面产生蓝色沉淀.此补充实验表明Cl-的作用是Cl-破坏了铁表面的氧化膜.
(3)有同学认为上述实验仍不严谨.为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验.其中能证实以上影响确实存在的是AC(填字母序号).
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是取出少许铁片(负极)附近的溶液于试管中,滴加K3[Fe(CN)6]溶液,若出现蓝色沉淀,则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀.
| 装置 | 分别进行的实验 | 现象 |
 | i.连好装置 一段时间后,向烧杯中滴加酚酞 | 碳棒附近溶液变红 |
| ii.连好装置 一段时间后,向烧杯中滴加[K3[Fe(CN)6] | 铁片表面产生蓝色沉淀 |
①实验i中的现象是碳棒附近溶液变红.
②用化学用语解释实验i中的现象:O2+2H2O+4e-═4OH-.
(2)查阅资料:K3[Fe(CN)6]具有氧化性.
①据此有同学认为仪通过ii中现象不能证明铁发生了电化学腐蚀,理由是铁电极能直接和K3[Fe(CN)6]溶液发生氧化还原反应生成Fe2+,会干扰由于电化学腐蚀负极生成Fe2+的检验
②进行下列实验,在实验几分钟后的记录如表:
| 实验 | 滴加 | 试管 | 现象 |
 | 0.5mol.LK3[Fe(CN)6]溶液 | iii.蒸馏水 | 无明显变化 |
| iv.1.0mol•L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
| v.0.5mol•L-1Na2SO4溶液 | 无明显变化 |
b.为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验III,发现铁片表面产生蓝色沉淀.此补充实验表明Cl-的作用是Cl-破坏了铁表面的氧化膜.
(3)有同学认为上述实验仍不严谨.为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验.其中能证实以上影响确实存在的是AC(填字母序号).
| 实验 | 试剂 | 现象 |
| A | 酸洗后的铁片K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
| B | 酸洗后的铁片K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
| C | 铁片K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
| D | 铁片K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
5. 含氯苯(
含氯苯( )的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
)的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
 含氯苯(
含氯苯( )的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )
)的废水可通过加入适量乙酸钠,设计成微生物电池将氯苯转化为苯而除去,其除去原理如图所示,下列叙述正确的是( )| A. | A极为负极,发生氧化反应 | B. | H+由A极穿过质子交换膜到达B极 | ||
| C. | A 极电极反应式为 +2e-+H+=Cl-+ +2e-+H+=Cl-+ | D. | 反应后电解液的pH升高 |

 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示: