题目内容
6.下列化学用语正确的是( )| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 四氯化碳分子的电子式: | D. | 乙酸乙酯的实验式:C2H4O |
分析 A.结构单元主链错误,丙烯中C=C双键中其中一个碳碳键断裂,发生自身加成聚合生成聚丙烯;
B.球棍模型突出的是原子之间的成键的情况及空间结构;
C.氯原子未成键的孤对电子对未画出;
D.实验式为各元素原子的最简比.
解答 解:A.聚丙烯的结构简式为: ,故A错误;
,故A错误;
B. 是丙烷的球棍模型,故B错误;
是丙烷的球棍模型,故B错误;
C.氯原子未成键的孤对电子对未标出,四氯化碳电子式为 ,故C错误;
,故C错误;
D.乙酸乙酯的实验式为C2H4O,故D正确,故选D.
点评 本题考查常用化学用语、质子数和中子数关系等,难度不大,A为易错点,注意理解加聚反应的原理,注意基础知识的理解掌握.

练习册系列答案
相关题目
16.500℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
下列说法正确的是( )
| 反应时间min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 增大压强对正逆反应速率没有影响,平衡不移动 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 由表格中数据得出,t1时刻该反应还未达到平衡 |
17.含氮的化合物广泛存在于自然界,是一类非常重要的化合物.回答下列有关问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
则该反应的△H=+1268kJ/mol.
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:
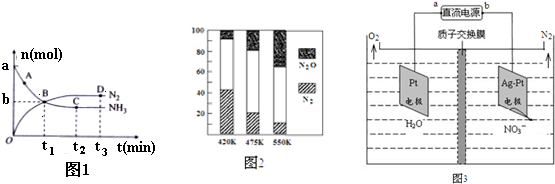
用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
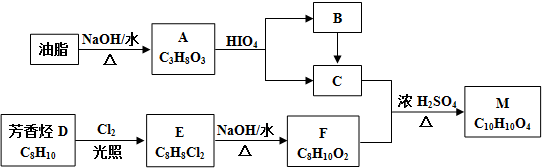
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g).已知该反应的相关的化学键键能数据如下:
| 化学键 | N≡N | H-O | N-H | O=O |
| E/(kJ/mol) | 946 | 463 | 391 | 496 |
(2)电厂烟气脱氮的主要反应
I:4NH3(g)+6NO(g)═5N2(g)+6H2O(g)△H<0,副反应
II:2NH3(g)+8NO(g)═5N2O(g)+3H2O(g)△H>0.
①反应I的化学平衡常数的表达式为K=$\frac{{c}^{6}({H}_{2}O){c}^{5}({N}_{2})}{{c}^{6}(NO){c}^{4}(N{H}_{3})}$.
②对于在2L密闭容器中进行的反应I,在一定条件下n(NH3) 和n(N2) 随时间变化的关系如图1所示:

用NH3表示从开始到t1时刻的化学反应速率为$\frac{a-b}{2{t}_{1}}$ (用a、b、t表示)mol/(L•min),图中表示已达平衡的点为CD.
③电厂烟气脱氮的平衡体系的混合气体中N2和N2O含量与温度的关系如图2所示,在温度420~550K时,平衡混合气体中N2O含量随温度的变化规律是随温度升高,N2的含量降低,造成这种变化规律的原因是主反应为放热反应,升温使主反应的平衡左移或者副反应为吸热反应,升温使副反应的平衡右移,降低了NH3和NO浓度,使主反应的平衡左移.
(3)电化学降解法可治理水中硝酸盐的污染.电化学降解NO3-的原理如图3所示,电源正极为a(填“a”或“b”),阴极电极反应式为2NO3-+10e-+12H+=N2+6H2O.
14.在1.0L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g)?2B(g)+C(g)+D(s)△H=+85.1kJ•mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
回答下列问题:
(1)下列操作能提高A转化率的是AD
A.升高温度 B.体系中通入A气体
C.通入稀有气体He,使体系压强增大到原来的5倍
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K=$\frac{{c}^{2}(B)×c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1
(3)平衡时A的转化率为70%.
A(g)?2B(g)+C(g)+D(s)△H=+85.1kJ•mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
| $\frac{P}{{P}_{0}}$ | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
(1)下列操作能提高A转化率的是AD
A.升高温度 B.体系中通入A气体
C.通入稀有气体He,使体系压强增大到原来的5倍
D.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K=$\frac{{c}^{2}(B)×c(C)}{c(A)}$,前2小时C的反应速率是0.02 mol•L-1•h-1
(3)平衡时A的转化率为70%.
11.为了鉴定溴乙烷中溴元素的存在,试分析下列各步实验:①加入AgNO3溶液 ②加入NaOH溶液 ③加热 ④用稀HNO3酸化溶液,其中操作顺序合理的是( )
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
2. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
计算得出待测烧碱溶液的物质的量浓度为0.08000mol•L-1.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol•L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至终点,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;
(2)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高(填“偏高”或“偏低”或“无影响”);
(3)如图是某次滴定时的滴定管中的液面,其读数为22.60mL;
(4)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
 $\stackrel{HIO_{4}}{→}$
$\stackrel{HIO_{4}}{→}$  +
+
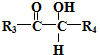 $\stackrel{HIO_{4}}{→}$R3COOH+
$\stackrel{HIO_{4}}{→}$R3COOH+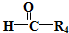
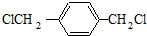 .
.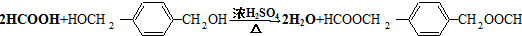 .
.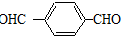
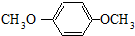

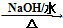 HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO
HOCH2CH2OH $\stackrel{HIO_{4}}{→}$HCHO 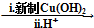 HCOOH
HCOOH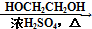 HCOOCH2CH2OOCH.
HCOOCH2CH2OOCH. (1)工业上用无水硫酸钠生产硫化钠的流程如下:
(1)工业上用无水硫酸钠生产硫化钠的流程如下: