题目内容
14.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
分析 根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液2L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液2L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)KJ/mol,
故选B.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1.
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
(1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5kJmol-1.
(2)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) 测得CH3OH的物质的量随时间的变化见图.

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ>KⅡ(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是bd.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有6个H-H断裂.
7.甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )


| A. | 丙与戊的原子序数相差28 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,庚和乙形成的化合物易溶于水 | |
| D. | 丁的最高价氧化物不与任何酸反应 |
2.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)画出原子的结构示意图:④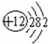 ,⑧
,⑧ ;
;
(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程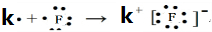 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)
(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
 | ⅠA | ⅡA | ⅢA | ⅠVA | VA | VⅠA | VⅡA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ |
(2)画出原子的结构示意图:④
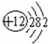 ,⑧
,⑧ ;
;(3)在表中有编号的元素中,金属性最强的元素是K,非金属性最强的元素是F,用电子式表示它们形成化合物的过程
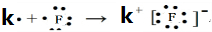 .最不活泼的元素是Ar.(以上均填元素名称)
.最不活泼的元素是Ar.(以上均填元素名称)(4)元素③、⑩、的氢氧化物碱性由强到弱的顺序KOH>NaOH;元素⑥、⑦、⑧的氢化物稳定性由弱到强的顺序SiH4<H2S<HCl(均用化学式填空)
(5)周期中有一种元素,其最高价氧化物的水化物与同周期其它元素最高价氧化物的水化物所属物质类型都不同,用离子方程式表示该水化物分别与烧碱溶液和稀硫酸的反应:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O;.
(6)与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,它与⑦的最高价氧化物的水化物浓溶液在加热时能反应,写出化学反应方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O
(7)写出能验证⑦的非金属性强于A的化学反应的离子方程式:CO32-+2H+=CO2↑+H2O.
9.元素的原子结构决定其性质和在周期表中的位置.下列说法正确的是( )
| A. | P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 元素原子的最外层电子数等于元素的最高化合价 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
19.下列有关说法正确的是( )
| A. | 在同温同压下,相同体积的任何气体含有相同数目的原子 | |
| B. | 氧化还原反应的本质是有电子转移 | |
| C. | Na2SO4溶液在电流作用下电离出Na+与SO42-而导电 | |
| D. | NaCl固体不导电,所以NaCl不是电解质 |
3.某有机物其结构简式为 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )
 ,关于该有机物下列叙述正确的是( )
,关于该有机物下列叙述正确的是( )| A. | 不能使酸性KMnO4溶液褪色 | |
| B. | 不能使溴水褪色 | |
| C. | 在加热和催化剂作用下,最多能和3mol H2反应 | |
| D. | 一定条件下,不能和NaOH醇溶液反应 |