题目内容
6.1.00gCH4完全燃烧生成液态水和CO2,放出55.6kJ的热量,写出CH4的燃烧热的热反应方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.分析 燃烧热是指在25℃、101kPa下,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物的物质的量必须为1mol,产物必须为稳定氧化物.
解答 解:1g CH4完全燃烧生成液态水和CO2气体,放出55.6kJ的热量,则1mol即16g CH4完全燃烧生成液态水和CO2气体,16×55.6kJ=889.6kJ,则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1;
点评 本题主要考查了热化学方程式的书写,注意热化学方程式的意义是解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.2mol•L-1的盐酸和硫酸各100mL,分别加入等质量的铁粉,反应后生成的气体质量比为2:3,则往盐酸中加入铁粉的物质的量为( )
| A. | 0.05mol | B. | 0.075mol | C. | 0.15mol | D. | 0.2mol |
14.在25℃、1.01×105Pa下,将22g CO2通入到750mL 1.0mol•L-1的NaOH溶液中充分反应,放出x kJ热量.在该条件下1molCO2通入到2L 1.0mol•L-1的NaOH溶液中充分反应,放出ykJ热量,则CO2与NaOH反应生成NaHCO3的热化学反应方程式为( )
| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
11.现有下列十种物质:①O2②Fe ③CaO ④CO2⑤H2SO4 ⑥Ba(OH)2⑦淀粉溶液⑧硫酸钠溶液⑨稀硝酸⑩Cu2(OH)2CO3
(1)请填写表格的空白处:
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学反应方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O.
(3)③与⑨发生反应的离子方程式为CaO+2H+=Ca2++H2O.
(4)⑦⑧两种试剂可以采用多种方法鉴别,请写出其中一种方法用光束照射,能够发生丁达尔效应的是淀粉溶液,余者为硫酸钠溶液.
(1)请填写表格的空白处:
| 分类标准 | 氧化物 | 电解质 | |||
| 属于该类的物质 | ② | ⑧⑨ | ⑦ |
(3)③与⑨发生反应的离子方程式为CaO+2H+=Ca2++H2O.
(4)⑦⑧两种试剂可以采用多种方法鉴别,请写出其中一种方法用光束照射,能够发生丁达尔效应的是淀粉溶液,余者为硫酸钠溶液.
18.下列电子式书写正确的是( )
| A. | HCl  | B. | HClO  | C. | H2O2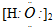 | D. | Na2O2 |
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:
 的含氧官能团的名称为醚键和羧基、羟基
的含氧官能团的名称为醚键和羧基、羟基 .
.