题目内容
设NA代表阿伏加德罗常数的数值,则下列说法正确的是( )
| A、1.8 g D2O含有NA个中子 |
| B、用5 mL 3 mol/L FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA |
| C、在Na2O2与CO2的反应中,每转移NA个电子时,消耗22.4 L的CO2 |
| D、25℃时,7 g C2H4和C3H6的混合气体中,含有NA个C-H键 |
考点:阿伏加德罗常数
专题:
分析:A、D2O的摩尔质量的考查,一分子D2O中含有中子数的10;
B、氢氧化铁胶体的制备,是利用铁离子的水解,水解是可逆的;
C、不是标准状况,不能使用气体摩尔体积vm=22.4L/mol;
D、可以将混合所体变成单一的气体(CH2)n,然后分析解题.
B、氢氧化铁胶体的制备,是利用铁离子的水解,水解是可逆的;
C、不是标准状况,不能使用气体摩尔体积vm=22.4L/mol;
D、可以将混合所体变成单一的气体(CH2)n,然后分析解题.
解答:
解:A、1.8g D2O的物质的量为
=0.09mol,含有0.9NA个中子,故A错误;
B、氢氧化铁胶体的制备,是利用铁离子的水解,水解是可逆的,所以含胶粒数小于0.015NA,故B错误;
C、每转移NA个电子时,消耗1mol的CO2,但题目没有告诉是否标况,故C错误;
D、可以将混合所体变成单一的气体(CH2)n,7g(CH2)n 物质的量为
=
mol,而1mol(CH2)n气体中含有2nmolC-H键,所以7g C2H4和C3H6的混合气体中,含有NA个C-H键,故D正确.
故选D.
| 1.8g |
| 20g/mol |
B、氢氧化铁胶体的制备,是利用铁离子的水解,水解是可逆的,所以含胶粒数小于0.015NA,故B错误;
C、每转移NA个电子时,消耗1mol的CO2,但题目没有告诉是否标况,故C错误;
D、可以将混合所体变成单一的气体(CH2)n,7g(CH2)n 物质的量为
| 7g |
| 14ng/mol |
| 1 |
| 2n |
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,难度不大,注意气体摩尔体积的使用范围和条件及重水的摩尔质量.

练习册系列答案
相关题目
常温下,0.1mol?L-1的一元酸HA与0.1mol?L-1的NaOH溶液等体积混合后,所得溶液pH>7,下列说法正确的是( )
| A、混合前一元酸HA的c(H+)=0.1 mol?L-1 |
| B、该混合溶液中:c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、HA在水溶液中的电离方程式:HA=H++A- |
| D、该混合溶液中:c(A-)+c(HA)=0.1 mol?L-1 |
下列说法正确的是( )
| A、反应A(g)?2B(g);△H,若正反应的活化能为Ea kJ mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 | ||
| B、标准状态下,将0.1 mol?L-1 的氨水溶液中加入少量氯化铵晶体,若混合溶液pH=7,则c(NH4+)=c(Cl-) | ||
| C、足量的锌铜合金与100mL pH=1 稀硫酸反应,反应3s 时测得pH=2,假设反应前后溶液的体积保持不变,则3s 内产生氢气的平均速率是33.6 mL?s-1 | ||
D、将浓度为0.1mol?L-1HF 溶液加水不断稀释过程中,电离度(α)和Ka(HF)保持不变,
|
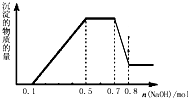 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
短周期元素X、Y、Z在元素周期表中的位置如图,关于X、Y、Z的说法正确的是( )


| A、相同条件下,三种元素的单质跟氢气反应时,X单质最剧烈 |
| B、Y的气态氢化物稳定性比Z的气态氢化物的稳定性强 |
| C、ZO2能与Z的最高价氧化物对应的水化物反应生成Z单质 |
| D、由氢、氧和Z元素形成的常见化合物中既含有离子键又含有共价键 |
金属钒被誉为“合金的维生素”.五氧化二钒(V2O5)中钒元素的化合价为( )
| A、-3 | B、+1 | C、+3 | D、+5 |
 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度.