题目内容
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.48g 正丁烷和 10g 异丁烷的混合物中共价键数目为 13NA
B.标准状况下,22.4LCl2 与水充分反应,转移电子数为 NA
C.标准状况下,1L 液态水中含有的H+数为 10ˉ7NA
D.2.0g D2O 和 H218O 的混合物中含有的质子数和中子数之和为 1.8NA
【答案】A
【解析】
A.丁烷分子中10个C-H键,3个C-C键,48g 正丁烷和 10g 异丁烷的混合物中共价键数目为![]() =13NA,故A正确;
=13NA,故A正确;
B.标准状况下,氯气与水的反应是可逆反应,22.4LCl2 与水充分反应,转移电子数少于 NA,故B错误;
C.标准状况下是0℃,常温下,1L 液态水中含有的H+数为 10ˉ7NA,而水的电离过程是吸热过程,降温,电离程度减小,所以标况下,电离出的氢离子数目小于10-7NA,故C错误;
D.D2O 和 H218O质子数和中子数之和均为20, 2.0g D2O 和 H218O 的混合物(为0.1mol)中含有的质子数和中子数之和为 2.0NA,故D错误;
故选A。

 名校课堂系列答案
名校课堂系列答案【题目】为了探究Fe2+、Cu2+、Ag+的氧化性强弱,设计实验如下图所示。
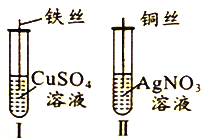
回答下列问题:
(1)写出AgNO3的电离方程式__________________________。
(2)已知实验Ⅰ、Ⅱ的现象和结论如下表:
实验编号 | 实验现象 | 实验结论 |
Ⅰ | ① | 氧化性:Cu2+>Fe2+ |
Ⅱ | 溶液变蓝色 | ② |
①实验Ⅰ的现象是_____________________
②实验Ⅱ的结论是______________________________。
③写出实验Ⅱ的离子方程式______________________________。
(3)Cu、Fe、CuSO4溶液、AgNO3溶液均能导电,其中属于纯净物有_________种,CuSO4溶液、AgNO3溶液均能导电的原因是_____________________。