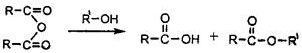题目内容
下列有关电解质溶液的说法正确的是( )
| A、KClO3和SO3溶于水能导电,故KClO3和SO3为电解质 |
| B、在蒸馏水中滴加浓H2SO4,Kw增大 |
| C、常温下将pH=4的醋酸溶液稀释后,溶液中导电离子的数目减少 |
| D、NaCl溶液和CH3COONH4溶液均呈中性,两溶液中水的电离程度相同 |
考点:强电解质和弱电解质的概念,弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:
分析:A、电解质是水溶液中或熔融状态下能导电的化合物;
B、浓硫酸溶于水放热,水的离子积常数与温度有关,温度升高,Kw增大;
C、稀释醋酸溶液促进醋酸的电离,溶液中氢离子与醋酸跟个数增多,但是由于溶液体积变化比个数增多的多,故浓度减小;
D、CH3COONH4促进水的电离.
B、浓硫酸溶于水放热,水的离子积常数与温度有关,温度升高,Kw增大;
C、稀释醋酸溶液促进醋酸的电离,溶液中氢离子与醋酸跟个数增多,但是由于溶液体积变化比个数增多的多,故浓度减小;
D、CH3COONH4促进水的电离.
解答:
解:A、电解质是水溶液中或熔融状态下能导电的化合物,SO3溶于水后能导电是因为和水反应生成的H2SO4能电离,和SO3本身无关,是非电解质,故A错误;
B、浓硫酸溶于水放热,水的离子积常数与温度有关,温度升高,Kw增大,故B正确;
C、稀释醋酸溶液促进醋酸的电离,溶液中氢离子与醋酸跟个数增多,但是由于溶液体积变化比个数增多的多,故浓度减小,故C错误;
D、CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故D错误,故选B.
B、浓硫酸溶于水放热,水的离子积常数与温度有关,温度升高,Kw增大,故B正确;
C、稀释醋酸溶液促进醋酸的电离,溶液中氢离子与醋酸跟个数增多,但是由于溶液体积变化比个数增多的多,故浓度减小,故C错误;
D、CH3COONH4促进水的电离,NaCl对水的电离无影响,所以两溶液中水的电离程度不同,故D错误,故选B.
点评:本题主要考查的是电解质与非电解质的概念、盐类水解的应用,弱酸的稀释等,难度不大.

练习册系列答案
相关题目
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )| A、X位于元素周期表中第三周期第IA 族 |
| B、W的基态原子核外有2个未成对电子 |
| C、X的单质和Y的单质相比,熔点较高的是X |
| D、Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl |
将a g氧化铁和硫化亚铁组成的混合物溶解在足量的稀酸中,结果得到b g沉淀,则原混合物中硫化亚铁的质量可能为( )
| A、5ab g | ||
| B、(a-5b)g | ||
C、(a-
| ||
D、
|
某不饱和烃的混合气体,其质量为相同状况下同体积H2的13.4倍,含有32g溴单质的溴水最多可吸收该混合气体2.24L(标准状况),则该混合烃是( )
| A、C2H4和C2H2 |
| B、C2H4和C3H4 |
| C、C3H4和C2H2 |
| D、C3H6和C3H4 |
用惰性电极电解一定量的CuSO4稀溶液,下列说法中正确的是( )
| A、阳极发生的电极反应为:Cu2++2e-=Cu |
| B、阴极发生的电极反应为:4OH-=2H2O+O2↑+4e- |
| C、若有6.4g金属Cu析出,放出的O2一定为0.05 mol |
| D、电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度 |