题目内容
11.有一瓶无色澄清溶液,其中可能含有H+、Na+、Mg2+、Ba2+、Cl-、SO42-、CO32-离子.现进行以下实验:A、用PH试纸检验溶液,发现溶液呈强酸性;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生.
①根据上述事实确定:该溶液中肯定存在的离子有H+、Ba2+、Cl-;肯定不存在的离子有Mg2+、SO42-、CO32-;
可能存在的离子有Na+.
②写出C中发生反应的离子方程式Ba2++CO32-=BaCO3↓.
分析 离子均为无色,
由A、用PH试纸检验溶液,发现溶液呈强酸性,可知一定含H+,则不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为BaCO3,可知原溶液一定含Ba2+,则不含SO42-,结合溶液为电中性来解答.
解答 解:①离子均为无色,由A、用PH试纸检验溶液,发现溶液呈强酸性,可知一定含H+,则不含CO32-;
B、取部分溶液逐滴加入NaOH溶液,使溶液由酸性变为碱性,无沉淀产生,则一定不含Mg2+;
C、取少量B中的碱性溶液,滴加Na2CO3溶液,有白色沉淀产生,则白色沉淀为BaCO3,可知原溶液一定含Ba2+,则不含SO42-,
结合溶液为电中性一定含阴离子为Cl-,不能确定是否含Na+,一定含H+、Ba2+、Cl-,一定不含Mg2+、SO42-、CO32-,
故答案为:H+、Ba2+、Cl-;Mg2+、SO42-、CO32-;Na+;
②C中发生反应的离子方程式为Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、常见离子之间反应与现象推断物质为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
1.高锰酸钾(KMnO4)是一种强氧化剂,在化学实验中被大量使用,下列关于它的性质和用途的叙述正确的是( )
| A. | 为了增强其氧化性,在配制时加入一定浓度的盐酸 | |
| B. | 该物质在反应中可以被还原,也可以被氧化 | |
| C. | 可用酸化的KMnO4溶液除去甲烷中的乙烯 | |
| D. | KMnO4中Mn元素为其最高价+7,故含有最高价元素的化合物,均有强氧化性,如浓硫酸、浓硝酸 |
2.物质不需要通过化学变化就能体现的性质是( )
| A. | 可燃性 | B. | 不稳定性 | C. | 挥发性 | D. | 氧化性 |
6.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 盐酸 | B. | 雾 | C. | 氯化钠溶液 | D. | CuSO4溶液 |
16.某化学兴趣小组设计以下实验步骤与操作来定性检验茶叶中含有的少量钙、铁、铝三种元素.
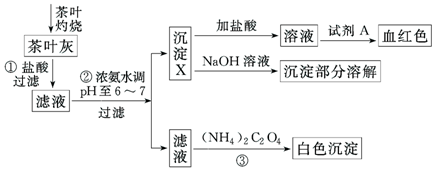
已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
(1)步骤①中加入盐酸的作用是使茶叶中的钙、铁、铝元素转化为离子.
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.

已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.
3.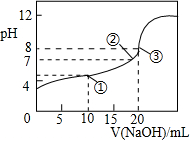 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
 25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )
25℃时,向20.00mL0.1mol•L-1HClO2溶液中逐滴加入0.1mol•L-1的NaOH溶液.溶液的pH与滴入NaOH溶液的体积的关系如图所示,则下列说法中不正确的是( )| A. | ①点时:c(ClO2-)>c(Na+)>c(H+)>c(OH-) | |
| B. | ②点时:c(Na+)=c(ClO2-) | |
| C. | ③点时:c(H+)=c(OH-)+c(HClO2) | |
| D. | 滴定过程中可能出现:c(Na+)>c(ClO2-)>c(OH-)>c(H+) |
12.下列离子方程式不正确的是( )
| A. | NaHCO3与NaOH溶液反应:HCO3-+OH-═CO32-+H2O | |
| B. | 氯气和水反应:Cl2+H2O?2H++Clˉ+ClOˉ | |
| C. | 氯化铁溶液中加入足量的氨水:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ | |
| D. | 盛放碱性试剂的溶液不能用玻璃塞的原因:SiO2+2OH-═SiO32-+H2O |
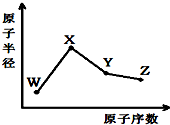 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题:
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.回答下列问题: .
.