题目内容
A-H均为链状有机物,它们之间有如图转化关系:
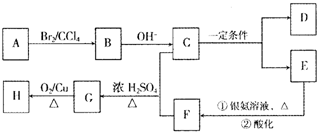
其中A、D常温下为气态,C的相对分子质量为90,C和乙二醇互为同系物,H能发生银镜反应.已知:
 (R、R′可以是烃基也可以是氢原子)
(R、R′可以是烃基也可以是氢原子)
(1)D的化学名称是 ;C的分子式是 ;
(2)C不能发生的反应是 (填字母).
a.氧化反应b.消去反应c.酯化反应d.加成反应
(3)H的结构简式是:
(4)写出下列反应的化学方程式:
E和银氨溶液共热的反应: .
C和F在浓硫酸作用下生成G的反应: .
(5)F的同分异构体中含有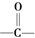 的异构体共有个 (不包含F),任写其中一种 .
的异构体共有个 (不包含F),任写其中一种 .

其中A、D常温下为气态,C的相对分子质量为90,C和乙二醇互为同系物,H能发生银镜反应.已知:
 (R、R′可以是烃基也可以是氢原子)
(R、R′可以是烃基也可以是氢原子)(1)D的化学名称是
(2)C不能发生的反应是
a.氧化反应b.消去反应c.酯化反应d.加成反应
(3)H的结构简式是:
(4)写出下列反应的化学方程式:
E和银氨溶液共热的反应:
C和F在浓硫酸作用下生成G的反应:
(5)F的同分异构体中含有
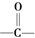 的异构体共有个
的异构体共有个考点:有机物的推断
专题:有机物的化学性质及推断
分析:C的相对分子质量为90,C和乙二醇互为同系物,设C的分子式为CnH2n+2O2,则14n+2+32=90,解得n=4,故C的分子式为C4H10O2,C在一定条件下发生信息中反应生成D、E,常温下D为气态,则D为HCHO,E能与银氨溶液发生氧化反应,则E为CH3CH2CHO,故C为CH3CH2CH(OH)CH2OH,B为CH3CH2CHBrCH2Br,A为CH3CH2CH=CH2,E氧化生成F为CH3CH2COOH,F与C发生酯化反应生成G,G发生氧化反应生成H,且H能发生银镜反应,则G为CH3CH2COOCH(CH2OH)CH2CH3,H为CH3CH2COOCH(CH2CH3)CHO,据此解得.
解答:
解:C的相对分子质量为90,C和乙二醇互为同系物,设C的分子式为CnH2n+2O2,则14n+2+32=90,解得n=4,故C的分子式为C4H10O2,C在一定条件下发生信息中反应生成D、E,常温下D为气态,则D为HCHO,E能与银氨溶液发生氧化反应,则E为CH3CH2CHO,故C为CH3CH2CH(OH)CH2OH,B为CH3CH2CHBrCH2Br,A为CH3CH2CH=CH2,E氧化生成F为CH3CH2COOH,F与C发生酯化反应生成G,G发生氧化反应生成H,且H能发生银镜反应,则G为CH3CH2COOCH(CH2OH)CH2CH3,H为CH3CH2COOCH(CH2CH3)CHO,
(1)由上述分析可知,D为HCHO,化学名称是:甲醛;C的分子式是C4H10O2,故答案为:甲醛;C4H10O2;
(2)C为CH3CH2CH(OH)CH2OH,含有醇羟基,可以发生氧化反应、消去反应、酯化反应,不能发生加成反应,故选:d;
(3)由上述分析可知,H的结构简式是:CH3CH2COOCH(CH2CH3)CHO,故答案为:CH3CH2COOCH(CH2CH3)CHO;
(4)E和银氨溶液共热的反应为CH3CH2CHO+2Ag(NH3)2OH
CH3CH2COONH4+2Ag↓+3NH3+H2O,
C和F在浓硫酸作用下生成G的反应为:CH3CH2COOH+CH3CH2CH(OH)CH2OH
CH3CH2COOCH(CH2OH)CH2CH3+H2O,
故答案为:CH3CH2CHO+2Ag(NH3)2OH
CH3CH2COONH4+2Ag↓+3NH3+H2O;CH3CH2COOH+CH3CH2CH(OH)CH2OH
CH3CH2COOCH(CH2OH)CH2CH3+H2O;
(5)F(CH3CH2COOH)的同分异构体中含有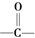 ,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,
,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,
故答案为:6;HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH任意一种.
(1)由上述分析可知,D为HCHO,化学名称是:甲醛;C的分子式是C4H10O2,故答案为:甲醛;C4H10O2;
(2)C为CH3CH2CH(OH)CH2OH,含有醇羟基,可以发生氧化反应、消去反应、酯化反应,不能发生加成反应,故选:d;
(3)由上述分析可知,H的结构简式是:CH3CH2COOCH(CH2CH3)CHO,故答案为:CH3CH2COOCH(CH2CH3)CHO;
(4)E和银氨溶液共热的反应为CH3CH2CHO+2Ag(NH3)2OH
| △ |
C和F在浓硫酸作用下生成G的反应为:CH3CH2COOH+CH3CH2CH(OH)CH2OH
| 浓硫酸 |
| △ |
故答案为:CH3CH2CHO+2Ag(NH3)2OH
| △ |
| 浓硫酸 |
| △ |
(5)F(CH3CH2COOH)的同分异构体中含有
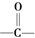 ,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,
,不包含F,则同分异构体含有酯基或醛基或羰基,符合条件同分异构体有:HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH,故答案为:6;HCOOCH2CH3、CH3COOCH3、CH3CH(OH)CHO、HOCH2CH2CHO、CH3OCH2CHO、CH3COCH2OH任意一种.
点评:本题考查有机物推断,计算确定C分子式是关键,再结合转化关系推断,需要学生熟练掌握官能团的性质与转化,综合考查学生分析能力与知识迁移运用,难度中等.

练习册系列答案
相关题目
碰撞理论是一种较直观的反应速率理论,下列有关碰撞理论叙述正确的是( )
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、K2SO4 |
| C、FeCl3 |
| D、NaCl |

 工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:
工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题: