题目内容
10.一定条件下的反应N2(g)+3H2(g)?2NH3(g)达到化学平衡的本质原因是( )| A. | 正、逆反应的速率相等且不为0 | B. | 反应体系中的气体压强保持不变 | ||
| C. | 正、逆反应都还在继续进行 | D. | 反应混合物中各组分的浓度相等 |
分析 可逆反应N2(g)+3H2(g)?2NH3(g)为气体体积缩小的反应,该反应达到化学平衡状态时,由于正逆反应速率相等,所以各组分的浓度、百分含量、压强不再变化,据此进行解答.
解答 解:A.可逆反应达到平衡状态时,正反应速率与逆反应速率一定相等,但不等于0,此为化学平衡的实质,故A正确;
B.反应体系中的气体压强保持不变,是由于正逆反应速率相等,压强不变不是化学平衡的本质,故B错误;
C.正、逆反应都还在继续进行是可逆反应特点,不是化学平衡的本质,故C错误;
D.反应混合物中各组分的浓度相等时不一定达到平衡状态,也不是化学平衡的本质,故D错误;
故选A.
点评 本题考查了化学平衡状态的判断及应用,题目难度不大,明确化学平衡状态的本质与特征为解答关键,注意可逆反应达到平衡状态时,正逆反应速率相等但不等于0.

练习册系列答案
相关题目
18.如图装置所示的实验中,不能达到实验目的是( )
| A. | 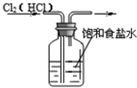 除去氯气中的氯化氢 | B. | 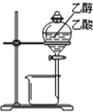 分离乙醇与乙酸 | ||
| C. | 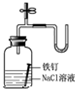 证明铁生锈空气参与反应 | D. | 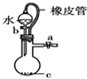 橡皮管的作用是控制水能顺利流下 |
5.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )
| A. | 3NO2+2H2O═2HNO3+NO | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | Cl2+H2O═HCl+HClO |
15.下列说法正确的是( )
| A. | 在多电子的原子里,能量高的电子通常在离核近的区域内活动 | |
| B. | 任何元素的原子都是由核外电子和核内中子、质子组成的 | |
| C. | 核素指一种原子,而元素是指一类原子;核素间互称同位素,元素包含同位素 | |
| D. | ${\;}_{18}^{40}$Ar、${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca的质量数相同,所以它们是互为同位素 |
2.下列各组性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 原子半径:Br>Cl>F |
19.下列说法中正确的是( )
| A. | 金属元素和非金属元素交界处最容易找到制催化剂的材料 | |
| B. | 电能是现代社会中应用最广泛、最方便的一次能源 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 煤块粉碎为煤粉的目的是提高煤的燃烧效率 |
