题目内容
5.下列反应中,氧化剂与还原剂物质的量的关系为1:2的是( )| A. | 3NO2+2H2O═2HNO3+NO | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | Cl2+H2O═HCl+HClO |
分析 A.只有N元素的化合价变化;
B.无元素的化合价变化;
C.I元素的化合价升高,Cl元素的化合价降低;
D.只有Cl元素的化合价变化.
解答 解:A.只有N元素的化合价变化,NO2为氧化剂、还原剂,由反应可知2molN失去电子与1molN得到电子相同,则氧化剂与还原剂物质的量的关系为1:2,故A选;
B.无元素的化合价变化,为非氧化还原反应,故B不选;
C.I元素的化合价升高,Cl元素的化合价降低,则I2为还原剂,NaClO3为氧化剂,氧化剂与还原剂物质的量的关系为2:1,故C不选;
D.只有Cl元素的化合价变化,Cl2为氧化剂、还原剂,氧化剂与还原剂物质的量的关系为1:1,故D不选;
故选A.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,注意氧化剂、还原剂的判断,题目难度不大.

练习册系列答案
相关题目
16.科学家预言,燃料电池将是21 世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极,电池中的质子交换膜只允许H+和水分子通过.其工作原理的示意图如下.下列说法错误的是( )
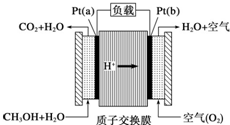

| A. | a 是负极,b 是正极 | |
| B. | b 极的电极反应是O2+4H++4e-=2H2O | |
| C. | 放电过程中,电子流动方向为:a→b→质子交换膜→a | |
| D. | 当电路上通过2 mol 电子消耗的CH3OH 为1/3mol |
20.在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应( )
A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体总物质的量 ⑤v(B)正与v(D)逆的比值为2:1 ⑥混合气体总质量.
A(s)+2B(g)?C(g)+D(g)已达到平衡状态的是
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体总物质的量 ⑤v(B)正与v(D)逆的比值为2:1 ⑥混合气体总质量.
| A. | ①③④⑤ | B. | ②③⑤⑥ | C. | ②③④⑤ | D. | ①②③⑥ |
10.一定条件下的反应N2(g)+3H2(g)?2NH3(g)达到化学平衡的本质原因是( )
| A. | 正、逆反应的速率相等且不为0 | B. | 反应体系中的气体压强保持不变 | ||
| C. | 正、逆反应都还在继续进行 | D. | 反应混合物中各组分的浓度相等 |
17.某烃完全燃烧生成CO25.28g和H2O 2.16g,经测定这种烃在标准状况下的密度为3.75g/L,则其分子式是( )
| A. | CH4 | B. | C3H8 | C. | C4H10 | D. | C6H12 |
14.如图是锌铜原电池的示意图.下列关于锌铜原电池的说法中错误的是( )
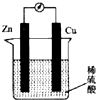

| A. | 锌为负极.锏为正极 | |
| B. | 铜片上有大童气泡生成 | |
| C. | 电流由锌片经导线流向铜片 | |
| D. | 当反应过程中有0.2 mol电子发生转移时,生成了 2.24 L氢气 |

 2NH3(g)在反应过程中的反应速率v与时间(t)的关系
2NH3(g)在反应过程中的反应速率v与时间(t)的关系 曲线,下列说法错误的是( )
曲线,下列说法错误的是( )
 逆反应速率
逆反应速率