题目内容
 (1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是
(2)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量
(3)已知在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,则上述反应的热化学方程式为
考点:中和热的测定
专题:化学反应中的能量变化
分析:(1)根据量热计的构造来判断该装置的缺少仪器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)依据酸碱中和反应的定义要点和热化学方程式的书写原则.
(2)反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答;
(3)依据酸碱中和反应的定义要点和热化学方程式的书写原则.
解答:
解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,
故答案为:环形玻璃搅拌器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并若60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 molH2O放出的热量,与酸碱的用量无关;
(3)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,该反应的热化学方程式可为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.
故答案为:环形玻璃搅拌器;
(2)反应放出的热量和所用酸以及碱的量的多少有关,并若60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,中和热数值相等,
故答案为:不相等;相等;因中和热是指稀强酸与稀强碱发生中和反应生成1 molH2O放出的热量,与酸碱的用量无关;
(3)在稀溶液中,强酸和强碱发生中和反应生成1mol H2O时,放出57.3kJ的热量,该反应的热化学方程式可为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-57.3 kJ/mol.
点评:本题考查学生有关中和热的测定知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列实验操作与安全事故处理正确的是( )
| A、做H2还原CuO的实验时,为防止H2爆炸,实验完毕,应先停止通H2,再停止加热 | ||
| B、配制稀硫酸溶液时,先在量筒加入一定体积的水,再沿容器壁慢慢加入浓硫酸,并不断搅拌 | ||
C、用试管夹从试管底由下往上夹住距离管口约
| ||
| D、分液漏斗在使用前要检漏,使用过程中要适当旋开活塞放气 |
根据化学反应的实质是旧键断裂、新键形成这一观点,下列变化属于化学反应的是( )
| A、碘升华 |
| B、NaCl的晶体加热熔化 |
| C、加热NH4HCO3分解 |
| D、HCl溶于水 |

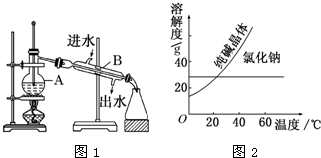 如图为实验室制取蒸馏水的装置示意图,回答下列问题:
如图为实验室制取蒸馏水的装置示意图,回答下列问题: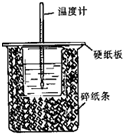 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液,在如右图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 图一、图二表示两种有机物.
图一、图二表示两种有机物.