题目内容
13.下列叙述正确的是( )| A. | 物质的量浓度为0.5 mol/L的MgCl2溶液,含有Cl- 个数为NA | |
| B. | V mL硫酸铁溶液中含有mg SO42-,则Fe3+的物质的量浓度为6.94m/V mol•L-1 | |
| C. | 将58.5 g NaCl溶解于1 L水中配成溶液,所得溶液的物质的量浓度为1 mol•L-1 | |
| D. | 用36.5%的浓盐酸(密度为1.25g•cm-3)配制成浓度为0.1mol•L-1的稀盐酸240mL,所需浓盐酸的体积为1.9mL |
分析 A.溶液体积不知道;
B.根据n=$\frac{m}{M}$计算硫酸根的物质的量,溶液中3n(Fe3+)=2n(SO42-),据此计算n(Fe3+),再根据c=$\frac{n}{V}$计算;
C.58.5 g NaCl为1mol,溶解于水中配成1L溶液,所得溶液浓度为1mol/L;
D.根据c=$\frac{1000ρω}{M}$计算浓盐酸的物质的量浓度,没有240mL容量瓶,需要配置250mL溶液,根据稀释定律计算需要浓盐酸的体积.
解答 解:A.溶液体积不明确,故溶液中的氯离子的个数无法计算,故A错误;
B.硫酸根的物质的量为$\frac{m}{96}$mol,溶液中3n(Fe3+)=2n(SO42-),则n(Fe3+)=$\frac{2}{3}$×$\frac{m}{96}$mol,故Fe3+的物质的量浓度为$\frac{\frac{2}{3}×\frac{m}{96}mol}{V×1{0}^{-3}L}$=$\frac{6.94m}{V}$mol•L-1,故B正确;
C.58.5 g NaCl为1mol,溶解于水中配成1L溶液,所得溶液浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故C错误;
D.没有240mL容量瓶,需要配置250mL溶液,根据稀释定律可知,需要浓盐酸的体积为$\frac{250mL×0.1mol/L}{12.5mol/L}$=2.0mL,故D错误,
故选B.
点评 本题考查物质的量浓度有关计算,注意对公式的理解与灵活应用,注意理解物质的量浓度与质量分数之间的关系,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
10.如果NO3-、Fe2+、SO42-、M四种离子以物质的量之比3:2:1:1共存于同一溶液中,那么,M可能是( )
| A. | Cl- | B. | Na+ | C. | H+ | D. | Mg2+ |
8.现有200mLc(H+)=0.1mol/L的MgCl2、AlCl3和HCl的混合溶液,其中c(Mg2+)=0.2mol•L-1,c(Cl-)=1.4mol•L-1,欲将该混合溶液中的Mg2+沉淀分离出去,则至少需要加入4mol•L-1的NaOH溶液( )
| A. | 80mL | B. | 72mL | C. | 85mL | D. | 128mL |
18.反应2X+3Y═2Z消耗X的质量与生成Z的质量关系如图所示,下列说法正确的是( )
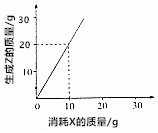

| A. | 有4g Z生成时,则消耗Y 3g | B. | X、Y、Z的摩尔质量之比为1:1:2 | ||
| C. | X、Y、Z的摩尔质量之比为2:3:2 | D. | X、Y、Z的摩尔质量之比为3:2:6 |
5.下列表达式正确的是( )
| A. | S2+的电子式为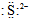 | B. | 碳原子的电子式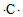 | ||
| C. | 氯原子的结构示意图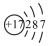 | D. | F-的结构示意图为 |
2.配制一定物质的量浓度的溶液,造成浓度偏高的操作是( )
| A. | 洗涤后的容量瓶未干燥 | B. | 移液后,未洗涤烧杯和玻璃棒 | ||
| C. | 定容时,眼睛视线俯视刻度线 | D. | 移液时,不慎将液体流到瓶外 |
3.下列各组物质,不能按  (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )
 (“→”表示反应一步完成)关系转化的是( )
(“→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | NaOH | NaHCO3 | Na2CO3 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A. | A | B. | B | C. | C | D. | D |