题目内容
20.制备干燥的氨气所需的药品是( )| A. | NH4Cl溶液、NaOH溶液、碱石灰 | B. | 浓氨水、NaOH固体、浓硫酸 | ||
| C. | NH4Cl固体、消石灰、碱石灰 | D. | 浓NaOH溶液、NH4C固体、浓硫酸 |
分析 实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,易溶于水,干燥氨气应用碱性或中性干燥剂,据此进行判断.
解答 解:A、氨气易溶于水,不能用溶液制备氨气,且无法获得干燥氨气,故A错误;
B、浓硫酸能够与氨气反应,不能干燥氨气,故B错误;
C、实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,可用碱石灰干燥,故C正确;
D、浓硫酸能够与氨气反应,使用干燥剂不能使用浓硫酸,故D错误;
故选C.
点评 本题考查氨气的制备和干燥,侧重于氨气性质的考查,较为基础,难度不大,实验室制备氨气可用氯化铵和消石灰反应,也可用浓氨水和碱石灰或氢氧化钠固体制备.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
10. “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg (OH)2下列关于该电池的说法错误的是( )| A. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| B. | 这种电池的工作原理可以认为是镁的吸氧腐蚀 | |
| C. | 活性炭电极上发生氧化反应 | |
| D. | 电池工作时实现了化学能向电能的转化 |
11. 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
 表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).
表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃).| 电解质 | 电离方程式 | 电离常数K | Ksp |
| H2CO3 | H2CO3?HCO3-+H+ HCO3-?CO32-+H+ | K1=4.31×10-7 K2=5.61×10-11 | - |
| H3PO4 | H3PO4?H2PO4-+H+ H2PO4-?HPO42-+H+ HPO42-?PO43-+H+ | K1=7.52×10-3 K2=6.23×10-6 K3=2.20×10-13 | - |
| C6H5OH | C6H5OH?C6H5O-+H+ | 1.1×10-10 | - |
| NH3•H2O | NH3•H2O?OH-+NH4+ | 1.76×10-5 | - |
| BaSO4 | BaSO4(s)?Ba2++SO42- | - | 1.1×10-10 |
| BaCO3 | BaCO3(s)?Ba2++CO32- | - | 1×10-9 |
(1)写出C6H5OH与Na3PO4反应的离子方程式:C6H5OH+PO43-=C6H5O-+HPO42-.
(2)25℃时,向10mL 0.01mol/LC6H5OH溶液中滴加V mL 0.1mol/L氨水,混合溶液中粒子浓度关系正确的是b(填序号).
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3•H2O)+2c(NH4+)═c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01mol/L C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义.25℃时,Na2CO3第一步水解反应的水解常数Kb=1.78×10-4mol/L.
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大).
①T2> 25℃(填“>”、“<”或“=”)
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是bc(填序号).
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
③某课外活动小组为探究BaSO4的溶解度,分子将足量的BaSO4放入:
a.5mL水
b.20mL 0.5mol•L-1的Na2SO4溶液
c.40mL 0.2mol•L-1的Ba(OH)2溶液
d.40mL 0.1mol•L-1的H2SO4溶液中,溶解至饱和
以上各溶液中,c(Ba2+)的大小顺序正确的是A,BaSO4的溶解度的大小顺序为C(填序号).
A.c>a>d>b B.c>a>b>d C.a>d>c>b D.a>c>d>b
④在BaCO3和BaSO4混合物悬浊液中,c(SO42-)与c(CO32-)之比为0.11(或1.1×10-1).
8.联氨(N2H4)是一种应用广泛的化工原料,可用作火箭燃料.已知:
①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
则2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )
①N2H4(l)+$\frac{1}{2}$N2O4(l)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-546.45kJ/mol
②H2O(g)═H2O(l)△H=-44.0kJ/mol
则2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g) 的△H是( )
| A. | -916.9 kJ/mol | B. | -458.45 kJ/mol | C. | +916.9 kJ/mol | D. | +458.45 kJ/mol |
12.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水中,有无色气泡(H+) | |
| B. | 新制氯水呈黄绿色(Cl2) | |
| C. | 使蓝色石蕊试纸先变红后褪色(H+、Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
9.下列说法不正确的是( )
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 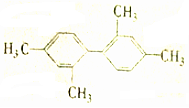 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物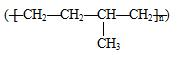 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
10.某溶液中有Fe2+、NH4+、Al3+、Fe3+等四种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中离子数目维持不变的阳离子是( )
| A. | Fe2+ | B. | NH4+ | C. | Al3+ | D. | Fe3+ |
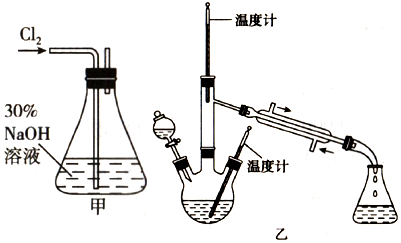 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):