题目内容
下列化学用语的表达正确的是( )
A、Na2SO4电离:Na2SO4=Na2++SO
| ||
B、Cl-的结构示意图: | ||
C、质子数为6,中子数为8的微粒:
| ||
| D、医用“钡餐”的化学式:BaSO4 |
考点:电离方程式的书写,核素,原子结构示意图,电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:A.硫酸钠为强电解质,在溶液中完全电离出钠离子和硫酸根离子,钠离子为带一个单位的正电荷的离子,电离方程式用等号连接;
B.根据粒子的质子数和电子数画出氯离子结构示意图进行判断;
C.质量数=质子数+中子数结合微粒的表示方法分析,质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.医用“钡餐”的成分为硫酸钡;
B.根据粒子的质子数和电子数画出氯离子结构示意图进行判断;
C.质量数=质子数+中子数结合微粒的表示方法分析,质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数;
D.医用“钡餐”的成分为硫酸钡;
解答:
解:A.硫酸钠在溶液中电离出钠离子和硫酸根离子,其电离方程式为:Na2SO4=2Na++SO42-,故A错误;
B.Cl-的质子数为17,电子数为18,离子结构示意图为: ,故B错误;
,故B错误;
C.质子数为6,中子数为8的微粒为碳-14,质量数为14,元素符号的左上角为质量数、左下角为质子数,正确的表示方法为:614C,故C错误;
D.医用钡餐是硫酸钡,其化学式可表示为:BaSO4,故D正确;
故选D.
B.Cl-的质子数为17,电子数为18,离子结构示意图为:
 ,故B错误;
,故B错误;C.质子数为6,中子数为8的微粒为碳-14,质量数为14,元素符号的左上角为质量数、左下角为质子数,正确的表示方法为:614C,故C错误;
D.医用钡餐是硫酸钡,其化学式可表示为:BaSO4,故D正确;
故选D.
点评:本题主要考查学生对化学用语的书写和理解能力,题目设计包含了电离方程式的书写、对化学符号意义的了解、离子结构示意图的书写、钡餐成分等知识,注意电解质在溶液中的电离、熟悉离子核外电子排布规则等知识是解题的关键,题目比较简单.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
下列各组物质的分类正确的是( )
| 选项 | 电解质 | 纯净物 | 碱性氧化物 | 酸性氧化物 |
| A | 酒精溶液 | 冰水混合物 | CaO | SO2 |
| B | BaSO4 | 液氯 | Fe2O3 | CO2 |
| C | Fe(OH)3 | CuSO4?5H2O | Al2O3 | SO2 |
| D | NH3 | 水银 | CuO | NO2 |
| A、A | B、B | C、C | D、D |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
H2(g)+
O2(g)=H2O(g)△H2
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
H2(g)+
| 1 |
| 2 |
C(s)+O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g)+O2(g)+6N2(g)的△H为( )
| A、12△H3+10△H2-2△H1 |
| B、2△H1-10△H2-12△H3 |
| C、12△H3-10△H2-2△H1 |
| D、△H1-10△H2-12△H3 |
用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、1 mol Cl2与足量的铁反应转移的电子数是2 NA |
| B、常温常压下22.4 L HCl气体含有的分子数是NA |
| C、0.1 mol/L CuCl2溶液中Cl-数目是0.2 NA |
| D、32 g O2中含有的原子数是 NA |
下列反应的化学方程式正确的是( )
A、工业制酒精:CH2=CH2+H2O
| |||
B、乙醇催化氧化:CH3CH2OH
| |||
C、实验室制乙酸乙酯:CH3COOH+CH3CH2OH
| |||
D、合成聚乙烯塑料:nCH2=CH2→ |
下列原子的价电子排布图正确的是( )
A、 |
B、 |
C、 |
D、 |
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
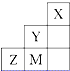

| A、电负性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
D、Z元素基态原子最外层电子排布图为 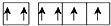 |
 按要求回答下列问题:
按要求回答下列问题: 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是