题目内容
10.一块表面被氧化的铝分成两等份,若向其中一份中滴加1mol•L-1 的NaOH溶液,向另一份中滴加x mol•L-1的稀盐酸,产生氢气的物质的量与所加NaOH溶液、稀盐酸的体积关系如图所示.下列说法不正确的是( )
| A. | 该铝块的总质量为16.92 g | |
| B. | a=200 | |
| C. | b=780 | |
| D. | 该铝块中氧化铝与铝单质的物质的量之比为3:20 |
分析 向其中一份中滴加1mol•L-1的NaOH溶液,铝样品表面的Al2O3先与NaOH溶液反应生成NaAlO2,根据图示可知溶解Al2O3消耗了60mL 1mol/LNaOH溶液,则生成n(NaAlO2)为1mol/L×0.06L=0.06mol,根据Al原子守恒可知n(Al2O3)=0.03mol,每份样品中m(Al2O3)为:102g/mol×0.03mol=3.06g;
样品中Al与NaOH、HCl反应生成n(H2)=0.3mol,根据电子守恒可知n(Al)为:$\frac{0.3mol×2}{3}$=0.2mol,每份样品中Al的质量为:27g/mol×0.2mol=5.4g;则每份样品的质量为:3.06g+5.4g=8.46g,该铝块的总质量为:8.46g×2=16.92g;
0.03molAl2O3与盐酸反应生成AlCl3,则溶解样品中的Al2O3消耗的n(HCl)为:0.03mol×6=0.18mol,则该C(HCl)=$\frac{0.18mol}{0.18L}$=1mol/L;生成0.3mol氢气消耗n(HCl)为0.6mol,消耗该V(HCl)=$\frac{0.6mol}{1mol/L}$=0.6L,则b=0.6L+0.18LmL=0.78L;
a点时所有Al元素都恰好转化成NaAlO2,则a点时n(NaAlO2)=0.06mol+0.2mol=0.26mol,则消耗V(NaOH)=$\frac{0.26mol}{1mol/L}$=0.26L=260mL.
解答 解:向其中一份中滴加1mol•L-1的NaOH溶液,铝样品表面的Al2O3先与NaOH溶液反应生成NaAlO2,根据图示可知溶解Al2O3消耗了60mL 1mol/LNaOH溶液,则生成n(NaAlO2)为1mol/L×0.06L=0.06mol,根据Al原子守恒可知n(Al2O3)=0.03mol,每份样品中m(Al2O3)为:102g/mol×0.03mol=3.06g;
样品中Al与NaOH、HCl反应生成n(H2)=0.3mol,根据电子守恒可知n(Al)为:$\frac{0.3mol×2}{3}$=0.2mol,每份样品中Al的质量为:27g/mol×0.2mol=5.4g;则每份样品的质量为:3.06g+5.4g=8.46g,该铝块的总质量为:8.46g×2=16.92g;
0.03molAl2O3与盐酸反应生成AlCl3,则溶解样品中的Al2O3消耗的n(HCl)为:0.03mol×6=0.18mol,则该C(HCl)=$\frac{0.18mol}{0.18L}$=1mol/L;生成0.3mol氢气消耗n(HCl)为0.6mol,消耗该V(HCl)=$\frac{0.6mol}{1mol/L}$=0.6L,则b=0.6L+0.18LmL=0.78L=780mL;
a点时所有Al元素都恰好转化成NaAlO2,则a点时n(NaAlO2)=0.06mol+0.2mol=0.26mol,则消耗V(NaOH)=$\frac{0.26mol}{1mol/L}$=0.26L=260mL;
A.通过以上分析知,该铝块的总质量为16.92 g,故A正确;
B.通过以上分析知,a=260,故B错误;
C.通过以上分析知,b=780,故C正确;
D.样品中氧化铝与铝的物质的量之比为:0.03mol:0.2mol=3:20,故D正确;
故选B.
点评 本题考查化学方程式有关计算,明确各个点中溶质是解本题关键,注意氧化铝、铝性质的特殊性,题目难度中等.

| A. | 非金属元素:Si、F、Be | B. | 盐:纯碱、碳铵、胆矾 | ||
| C. | 混合物:空气、石油、冰水共存物 | D. | 单质:硫磺、金刚石、水晶 |
| A. | 乙醇能使酸性KMn04溶液和酸性K2Cr207溶液褪色,均被氧化成乙酸 | |
| B. | 向酸性高锰酸钾中加入草酸溶液,随着反应的进行,反应速率逐渐减小 | |
| C. | 向某溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该溶液中存在S042-或S032- | |
| D. | 实验室提纯混有少量氯化钠的硝酸钾,通常采用重结晶的方法 |
| A. | 二氧化碳与水反应 | B. | Na与水反应 | ||
| C. | 氨气与水反应 | D. | 过氧化钠与水反应 |
| A. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| B. | 1 L 1 mol•L-1氨水中,NH4+和OH-总数为2NA | |
| C. | 常温常压下,6 0g 二氧化硅含有的氧原子数目为2NA | |
| D. | 22.4LCl2与足量的FeCl2溶液充分反应转移的电子数为2NA |
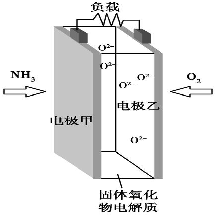 科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )
科技工作者研究出以NH3为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示).该固体氧化物电解质的工作温度高达700~900℃,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质.下列说法正确的是( )| A. | 电极甲为电池正极 | |
| B. | 电池总反应为4NH3+5O2═4NO+6H2O | |
| C. | 电池正极反应式为O2+2H2O+4e-═4OH- | |
| D. | 图示中的O2-由电极乙移向电极甲 |
 ,该化合物中含有的化学键有离子键、共价键
,该化合物中含有的化学键有离子键、共价键