题目内容
19.用硫铁矿(主要含FeS2、SiO2等)制备莫尔盐的流程如下: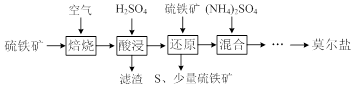
已知:“还原”时,FeS2与H2SO4不反应.加人FcS2还原时发生反应Ⅰ、Ⅱ,其中反应Ⅰ为FeS2+14Fe3++8H20=15F2++2SO42-+16H+.
①“沉淀”时,溶液pH不宜过高,否则制备的FeCO3中可能混有的杂质是Fe(OH)3.
②写出“还原”时反应Ⅱ的离子方程式:2Fe3++FeS2=2S↓+3Fe2+.
分析 ①pH过高时溶液中的亚铁离子会转化氢氧化亚铁沉淀,进而生成氢氧化铁;
②三价铁离子氧化硫化亚铁,氧化产物可能为硫酸根离子,也可能为硫单质,反应Ⅰ氧化产物为硫酸根离子,所以反应Ⅱ氧化产物为硫单质,分析反应中元素化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒写出方程式.
解答 解:①pH过高时溶液中的亚铁离子会转化氢氧化亚铁沉淀,进而生成氢氧化铁,制备FeCO3应控制溶液pH不宜过高,否则会产生氢氧化铁沉淀;
故答案为:Fe(OH)3;
②三价铁离子氧化硫化亚铁,氧化产物可能为硫酸根离子,也可能为硫单质,反应Ⅰ氧化产物为硫酸根离子,所以反应Ⅱ氧化产物为硫单质,反应中1mol三价铁离子化合价降为二价铁离子,得到1mol电子,FeS2中,-1价硫升高到0价,1molFeS2失去2mol电子,要使得失电子守恒,三价铁离子系数为2,FeS2系数为1,依据原子个数守恒方程式:2Fe3++FeS2=2S↓+3Fe2+;
故答案为:2Fe3++FeS2=2S↓+3Fe2+.
点评 本题考查了铁及其化合物的性质,明确三价铁离子沉淀的pH值,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
9.下列除杂的实验过程不正确的是(括号内为除杂物)( )
| A. | KCl(K2CO3)加足量稀硫酸,过滤,蒸发,结晶 | |
| B. | BaSO4(BaCO3)加足量稀盐酸,过滤,洗涤,干燥 | |
| C. | CuO(Cu) 在空气中充分灼烧 | |
| D. | CaCO3(CaCl2)加水溶解,过滤,洗涤,干燥 |
10.W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是( )
| A. | W2-、X+ | B. | X+、Y3+ | C. | X+、Z2- | D. | Y3+、Z2- |
7.对于相同质量的CO和CO2,下列关系正确的是( )
| A. | 所含氧原子的个数之比为1:2 | B. | 所含碳元素的质量之比为7:11 | ||
| C. | 所含氧元素的质量之比为11:14 | D. | 所含碳原子的个数之比为1:1 |

 如图是实验室制取乙酸乙酯的装置.请回答下列问题:
如图是实验室制取乙酸乙酯的装置.请回答下列问题:
 、CO,你认为其中含量最大的是HCl.
、CO,你认为其中含量最大的是HCl.