题目内容
11.下列说法正确的是( )| A. | 在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变 | |
| B. | 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3 | |
| C. | 25℃时,用pH相同的稀醋酸和盐酸分别中和同浓度、同体积的NaOH溶液至混合溶液呈中性时,消耗稀醋酸和盐酸的体积相同 | |
| D. | 25℃时,pH=9的NH4Cl与NH3•H2O混合溶液中c(Cl-)>c(NH4+) |
分析 A.酸溶液中稀释OH-离子浓度增大,碱溶液中稀释H+离子浓度增大,中性稀释溶液中OH-、H+离子浓度不变;
B.水解生成的盐酸为挥发性酸,水解生成亚硫酸易被氧化为硫酸;
C.醋酸溶液中存在电离平衡,pH相同的稀醋酸和盐酸溶液中,醋酸浓度大,中和同浓度、同体积的NaOH溶液至混合溶液呈中性时消耗醋酸溶液少;
D.25℃时,pH=9的NH4Cl与NH3•H2O混合溶液中,一水合氨电离大于铵根离子的水解.
解答 解:A.酸溶液中稀释时OH-离子浓度增大,碱溶液中稀释时H+离子浓度增大,中性溶液如NaCl溶液稀释时OH-、H+离子浓度不变,故A正确;
B.因AlCl3溶液水解生成的盐酸为挥发性酸,Na2SO3溶液水解生成亚硫酸易被氧化为硫酸,则AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO4,故B错误;
C.pH相同的稀醋酸和盐酸溶液中,醋酸浓度大,中和同浓度、同体积的NaOH溶液至混合溶液呈中性时消耗醋酸溶液少,故C错误;
D.25℃时,pH=9的NH4Cl与NH3•H2O混合溶液中,一水合氨电离大于铵根离子的水解,溶液中c(Cl-)<c(NH4+),故D错误;
故选A.
点评 本题考查盐类水解平衡、弱电解质电离平衡的影响因素,注重电离平衡、盐类水解影响因素的考查,题目难度不大.

练习册系列答案
相关题目
1.如图为元素周期表前四周期的一部分.X原子最外层电子数是其内层电子数的3倍.下列说法正确的是( )
| X | ||||
| Y | Z | T | ||
| W |
| A. | TX2、T2或X3均可用于做杀菌消毒 | |
| B. | W元素的单质溶于水和汽化都只破坏了分子间作用力 | |
| C. | 元素T的非金属性比W强,所以HT的酸性比HW的酸性强 | |
| D. | YT3在常压、178℃时升华,所以YT3中只含有离子键,而ZT4中只含有共价键 |
2. 青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )
青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )
 青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )
青蒿酸是合成青蒿素的原料,可以由香草醛合成:下列叙述不正确的是( )| A. | 青蒿酸可以发生酯化反应 | |
| B. | 青蒿酸环上的一氯代物有10种 | |
| C. | 香草醛和H2反应,最多消耗H24 mol | |
| D. | 可用FeCl3溶液或NaHCO3溶液鉴别香草醛和青蒿酸 |
16.当干冰气化时,下列所述各项中发生变化的是( )
| A. | 分子间距离 | B. | 范德华力 | C. | 分子内共价键 | D. | 化学性质 |
3.要除去Cu(OH)2中混有的Al(OH)3,最好的方法是( )
| A. | 用盐酸洗涤过滤 | B. | 用加热还原 | ||
| C. | 用CO加热还原 | D. | 用NaOH溶液洗涤,过滤 |

 (R、R′为烃基)
(R、R′为烃基) ,D的化学式为C8H11O2Na.
,D的化学式为C8H11O2Na. .
. .
. .
.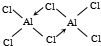 (标出配位键).
(标出配位键).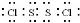 ,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.
,它水解的化学方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl.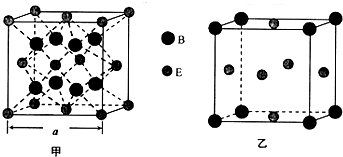




 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题: