题目内容
12. 氮及其化合物与人们的生活息息相关,请回答下列有关问题.
氮及其化合物与人们的生活息息相关,请回答下列有关问题.(1)实验室可用铜与浓硝酸反应制取NO2,其离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)为防止环境污染,可用碱液吸收氮的氧化物.
NO与NO2按物质的量之比1:1被NaOH溶液完全吸收后得到一种钠盐,该反应的化学方程式是NO+NO2+2NaOH=2NaNO2+H2O.
(3)汽车尾气和硝酸工厂的尾气中含有NO和NO2.同温同压下,3.5L NH3恰好将3.0L NO和NO2的混合气完全转化为N2,则原混合气中NO和NO2的体积比是1;3.
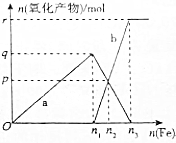
(4)含有1mol HNO3的稀硝酸分别与不同的质量的铁粉反应,所得氧化产物a、b与铁粉物质的量的关系如图所示,则b
是Fe(NO3)2,n3=0.375,p=0.15.
分析 (1)铜与浓硝酸反应生成硝酸铜、NO2与水;
(2)NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2;
(3)氮氧化物与氨气发生的反应是氧化还原反应,氮氧化物把氨气氧化为氮气,本身被还原为氮气,可以利用反应方程式通过设未知列方程组计算;也可以根据氧化还原反应的电子守恒计算;也可以利用平均值法计算;
(4)向稀硝酸中加入铁粉时,开始先生成Fe(NO3)3,当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2,反应涉及两个方程式.
解答 解:(1)铜与浓硝酸反应生成硝酸铜、NO2与水,反应离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)NO与NO2发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,反应的化学方程式为:NO+NO2+2NaOH=NaNO2+H2O,
故答案为:NO+NO2+2NaOH=NaNO2+H2O;
(3)根据反应可知:氨气被氧化为氮气,NH3~N2~3e-;一氧化氮被还原为氮气,NO~N2~2e-二氧化氮被还原为氮气
NO2~N2~4e-
设一氧化氮体积为x,二氧化氮体积为3-x,氨气的体积为3.5L,根据电子守恒可知:3.5L×3=2x+4×(3-x),
x=0.75L,二氧化氮体积为2.25L,则相同条件下,混合气体中NO和NO2的体积比等于物质的量之比=0.75:2.25=1:3,
故答案为:1:3;
(4)向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4mol利用方程式可计算出生成的 Fe(NO3)3为1mol,则硝酸为1mol生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,
Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,设生成的 Fe(NO3)2物质的量xmol,则利用方程式可求得,
2Fe(NO3)3+Fe=3 Fe(NO3)2,
2 3
0.25mol-x x
x=0.15,即P=0.15,
再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)),所以 n(Fe)=0.3mol即n2=0.3mol,
P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,物质的量为0.15mol,加入铁最后到r点,溶质全部为 Fe(NO3)2,2Fe(NO3)3+Fe=3 Fe(NO3)2消耗铁物质的量为0.075mol,生成硝酸亚铁0.225mol,则n3=0.375mol,
故答案为:Fe(NO3)2;0.375;0.15;
点评 本题考查了氮氧化物发生的化学反应、氧化还原反应电子转移、铁与稀硝酸的反应,要注意铁和硝酸谁多谁少,以及加入的顺序,注意图象中曲线的变化实质理解应用,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | X、Y、Z、W四种元素的最外层电子数之和为18 | |
| B. | 原子半径由大到小的顺序:W>Z>Y>X | |
| C. | 单质的熔点:W>Z | |
| D. | 简单气态氢化物的稳定性:X>Y>W |
| A. | 蜡烛燃烧 | B. | 酒精挥发 | C. | 瓷碗破碎 | D. | 雪糕熔化 |
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 实验结束后,用嘴吹灭酒精灯 | |
| C. | 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗 | |
| D. | 金属钠着火,立即用水扑灭 |
 CaCl2
CaCl2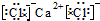 Na2O2
Na2O2 OH-
OH- CH3-
CH3- NaOH
NaOH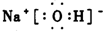
 .
. .
. .
.