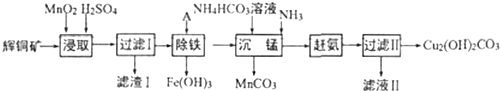
题目内容
3.根据下列叙述,写出元素名称①B元素原子的最外层电子数是次外层电子数的1.5倍:硼;
②C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃:氟;
③D元素的次外层电子数是最外层电子数的$\frac{1}{4}$:氖;
④1~36号元素原子核外电子排布中未成对电子数最多:铬.
分析 (1)B元素原子的最外层电子数是次外层电子数的1.5倍,最外层电子数不超过8,故该原子只能有2个电子层,最外层电子数为3;
(2)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃,说明生成氧气;
(3)D元素的次外层电子数是最外层电子数的$\frac{1}{4}$,最外层电子数不超过8,则次外层为K层,最外层电子数为8;
(4)1~36号元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满.
解答 解:(1)B元素原子的最外层电子数是次外层电子数的1.5倍,最外层电子数不超过8,故该原子只能有2个电子层,最外层电子数为3,为硼元素,
故答案为:硼;
(2)C元素的单质在常温下可与水剧烈反应,产生的气体能使带火星的木条复燃,则C为氟元素,
故答案为:氟;
(3)D元素的次外层电子数是最外层电子数的$\frac{1}{4}$,最外层电子数不超过8,则次外层为K层,最外层电子数为8,为氖元素,
故答案为:氖;
(4)1~36号元素原子核外电子排布中未成对电子数最多的元素,故元素原子3d、4s均为半满,元素原子的价电子构型为3d54s1,则其基态原子的核外电子排布式[Ar]3d54s1,原子核外共24个电子,为Cr元素;
故答案为:铬.
点评 本题考查核外电子排布、结构与位置关系,为高频考点,侧重于学生的分析能力的考查,答题关键是对核外电子排布规律的理解掌握,有利于基础知识的巩固.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目
11.如表符号中“2”的含义正确的一组是( )
| 12H | 2Hc | Cl2 | Cu2+ | |
| A | 质量数 | 中子数 | 质子数 | 电荷数 |
| B | 质量数 | 质子数 | 原子数 | 电荷数 |
| C | 质子数 | 中子数 | 原子数 | 电子数 |
| D | 质量数 | 质子数 | 分子数 | 电荷数 |
| A. | A | B. | B | C. | C | D. | D |
18.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b用导线连接时,该装置为原电池,铁片为负极,发生氧化反应 | |
| B. | a和b用导线连接时,Pt片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极时,该装置为电解池,Pt片为阳极,电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | a和b分别连接直流电源正、负极时,Cu2+向Pt电极移动 |
8.分子式为C5H10O2的酯共有(不考虑立体异构)( )
| A. | 10种 | B. | 7种 | C. | 6种 | D. | 9种 |
12.下列说法不正确的是( )
| A. | 木炭在氧气中剧烈燃烧,生成黑色固体 | |
| B. | 铁丝在氧气中燃烧,火星四射 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 硫在空气中燃烧,生成有刺激性气味气体 |
13.结构简式为CH3(CH2)2C(CH3)2CH(CH3)2的有机物的一氯代物有( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
 氮及其化合物与人们的生活息息相关,请回答下列有关问题.
氮及其化合物与人们的生活息息相关,请回答下列有关问题. .
. .
.