题目内容
3.KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,某同学先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作
(1)试剂Ⅰ的化学式为BaCl2或Ba(OH)2,其作用是除去SO42-(填离子符号),检验该离子完全除尽的操作是静置,取少量上层澄清溶液于试管中,再滴加氯化钡或氢氧化钡溶液,若无白色沉淀产生,则原溶液中SO42-除尽,反之则未除尽
(2)加入试剂Ⅱ时发生反应的化学方程式为BaCl2+K2CO3=2KCl+BaCO3↓或Ba(OH)2+K2CO3=2KOH+BaCO3↓
(3)试剂Ⅲ的名称是盐酸,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用B(填字母).
A.AgNO3B.pH试纸 C.K2CO3溶液.
分析 KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,由流程可知,滤液①中加试剂I为BaCl2或Ba(OH)2,操作①为过滤,分离出B为BaSO4,滤液A含BaCl2、KOH、KCl,加试剂II为K2CO3发生BaCl2+K2CO3=2KCl+BaCO3↓,操作②为过滤,分离出C含BaCO3,D中含KCl、K2CO3,再加适量盐酸,③中发生K2CO3+2HCl=2KCl+H2O+CO2↑,④中蒸发得到KCl晶体,以此来解答.
解答 解:(1)试剂Ⅰ的化学式为BaCl2或Ba(OH)2,其作用是除去SO42-,检验该离子完全除尽的操作是静置,取少量上层澄清溶液于试管中,再滴加氯化钡或氢氧化钡溶液,若无白色沉淀产生,则原溶液中SO42-除尽,反之则未除尽,
故答案为:BaCl2或Ba(OH)2;SO42-;静置,取少量上层澄清溶液于试管中,再滴加氯化钡或氢氧化钡溶液,若无白色沉淀产生,则原溶液中SO42-除尽,反之则未除尽;
(2)加入试剂Ⅱ时发生反应的化学方程式为BaCl2+K2CO3=2KCl+BaCO3↓或Ba(OH)2+K2CO3=2KOH+BaCO3↓,
故答案为:BaCl2+K2CO3=2KCl+BaCO3↓或Ba(OH)2+K2CO3=2KOH+BaCO3↓;
(3)试剂Ⅲ的名称是盐酸,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用pH试纸,而加硝酸银、碳酸钾会引入新杂质,不宜检验是否过量,
故答案为:盐酸;B.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重于学生的分析和实验能力的考查,注意把握物质的性质的异同,考虑实验设计的严密性,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2. 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )
如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极 上析出6.4g某金属,下列说法正确的是( )| A. | 甲池是b极上析出金属银,乙池是c极上析出某金属 | |
| B. | 甲池是a极上析出金属银,乙池是d极上析出某金属 | |
| C. | 某盐溶液可能是CuSO4溶液 | |
| D. | 某盐溶液可能是Mg(NO3)2溶液 |
8.下列有关环境、健康及能源的叙述中,不正确的是( )
| A. | 氮的氧化物是光化学烟雾的主要污染物,二氧化碳是温室效应的主要污染物,所以它们的含 量是空气质量报告的主要项目 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害的物质,对人的肺功能造成很大伤害 | |
| C. | 聚乙烯是生产食品保鲜膜、塑料水杯等生活用品的主要材料,不能用聚氯乙烯替代 | |
| D. | 利用催化转化装置可以将汽车尾气中的NOx、CO等有害气体转化为N2、CO2等无害气体 |
15.下列有关化学键的叙述,正确的是( )
| A. | 单质分子中均含共价键 | |
| B. | 由不同元素组成的多原子分子里,只存在极性键 | |
| C. | HF与HBr相比,分子内共价键更强,所以HF沸点更高 | |
| D. | 硫酸氢钠溶于水既有离子键被破坏又有共价键被破坏 |
13.氮的化合物既是一种资源,也会给环境造成危害.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
则表中z(用x a b d表示)的大小为x-d+b+2a.
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).
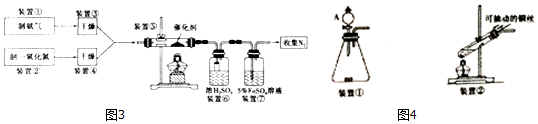
(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).

(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
 反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中 进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题:
反应A(g)?B(g)+C(g)在容积为1.0L的密闭容器中 进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如图所示.回答下列问题: 是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$
是一种有机烯醚,可以用烃A通过下列路线获得A$→_{①}^{Br_{2}/CCl}$B$→_{②}^{NaOH水溶液/△}$C$→_{③}^{浓H_{2}SO_{4}/△}$ 的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH
的同分异构体的结构简式(写出2种)HC≡CCH2CH2OH、CH3C≡CCH2OH 4-甲基-3-乙基-2-己烯;
4-甲基-3-乙基-2-己烯;  2,2,3-三甲基戊烷;
2,2,3-三甲基戊烷; 1,4-二乙基苯.
1,4-二乙基苯. .
. 已知某粒子的结构示意图如图.试回答:
已知某粒子的结构示意图如图.试回答: