题目内容
16.利用“化学计量在实验中的应用”相关知识填空.(1)含有6.02×1023个氢原子的H2SO4的物质的量是0.5mol;
(2)在一定的温度和压强下,1体积X2(气)跟3体积Y2(气)化合生成2体积化合物,则该化合物的化学式是XY3或Y3X;
(3)三种正盐的混合溶液中含有0.2mol Na+、0.25mol Mg2+、0.4mol Cl-、SO42-,则n(SO42-)为0.15mol.
分析 (1)根据公式n=$\frac{N}{{N}_{A}}$进行计算;
(2)一定温度与压强下,气体的体积之比等于物质的量之比,等于化学计量数之比,然后利用质量守恒定律来确定化学式;
(3)溶液中阴离子和阳离子的正负电荷守恒,根据守恒思想来计算.
解答 解:(1)6.02×1023个氢原子,即氢原子的物质的量是1mol,所以H2SO4的物质的量是0.5mol,故答案为:0.5mol;
(2)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,
则X2+3Y2═2Z,由原子守恒可知,Z为XY3,故答案为:XY3或Y3X;
(3)溶液中阴离子和阳离子的正负电荷守恒,即n(Na+)+2n( Mg2+)=n (Cl-)+2n(SO42-),所以0.2 mol+2×0.25 mol=0.4 mol+2n(SO42-),解出n(SO42-)=0.15mol,故答案为:0.15mol.
点评 本题考查学生物质的量的有关计算知识,可以根据所学知识结合对计算公式的理解来回答,难度不大.

练习册系列答案
相关题目
6.被称为红帘石的铁矿含锰量高,锰是冶炼锰钢的重要原料.红帘石主要成分有磁铁矿(Fe3O4)、菱铁矿(FeCO3)、锰矿(MnO2和MnCO3)、石棉[Mg3Si3O7(OH)4]等.工业上将红帘石处理后,运用阴离子膜电解法的新技术提取金属锰并制得高效水处理剂(K2FeO4).工业流程如下:

(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
①粉碎红帘石②提高反应的温度.
(2)浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+.(填离子符号)
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+.
(4)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:

过程②中加氨水调节溶液的pH等于6,则滤渣B的成分Fe(OH)3.
(5)电解装置如图所示,则溶液中阴离子移动的方向为A→B(填“A→B”或“B→A”).实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为2H2O-4e-=O2↑+4H+.
(6)滤渣B经反应④生成高效水处理剂的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.K2FeO4被誉为高效水处理剂的原因是FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.

(1)工业上为提高稀硫酸浸取效率一般采取的措施是(任意写两种方法)
①粉碎红帘石②提高反应的温度.
(2)浸出液中的阳离子有H+、Fe2+、Fe3+、Mg2+、Mn2+.(填离子符号)
(3)滤渣A中无MnO2原因MnO2在酸性条件下被二价铁还原为Mn2+.
(4)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
| 离子 | Fe3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 7.0 | 7.8 | 9.3 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.8 | 10.8 |

过程②中加氨水调节溶液的pH等于6,则滤渣B的成分Fe(OH)3.
(5)电解装置如图所示,则溶液中阴离子移动的方向为A→B(填“A→B”或“B→A”).实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为2H2O-4e-=O2↑+4H+.
(6)滤渣B经反应④生成高效水处理剂的离子方程式2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O.K2FeO4被誉为高效水处理剂的原因是FeO42-具有强氧化性可以杀菌消毒,还原成Fe3+水解成Fe(OH)3胶体能吸附杂质生成沉淀.
7.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)(填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液完全中和,则消耗的NaOH溶液的体积大小关系为:V(甲)<V(乙)(填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO${\;}_{3}^{-}$ B.CO${\;}_{3}^{2-}$ C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+NaCO2(少量):2CH3COOH+CO32-=H2O+CO2↑+2CH3COO-;
HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
4.下列实验操作一定能够达到目的是( )
| A. | 向某溶液中滴加盐酸酸化的Ba(NO3)2溶液,有白色沉淀生成,则该溶液中一定含有SO42- | |
| B. | 用饱和NaHCO3溶液除去CO2气体中混有的少量SO2 | |
| C. | 将产生的气体依次通过足量的溴水和澄清石灰水,检验浓H2SO4与木炭反应生成的气体产物 | |
| D. | 实验室制取氢气,为了加快反应速率,可向稀硫酸中滴加少量Cu(NO3)2 |
11.装运浓硫酸的储运罐应贴的标志是( )
| A. |  | B. |  | C. |  | D. |  |
8.近几年流行喝苹果醋.苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构式为 ,下列说法不正确的是( )
,下列说法不正确的是( )
 ,下列说法不正确的是( )
,下列说法不正确的是( )| A. | 苹果酸在一定条件下能发生酯化反应 | |
| B. | 苹果酸在一定条件下能发生催化氧化反应 | |
| C. | 苹果酸在一定条件下能发生加成反应 | |
| D. | 苹果酸在一定条件下能发生缩聚反应 |
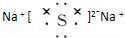 .
.