题目内容
含有相同质量的氮原子的NO、NO2、N2O3、N2O5和N2O中,含氧原子的质量比为( )
| A、1:2:3:5:1 |
| B、2:4:3:5:1 |
| C、16:30:20:10:5 |
| D、30:15:20:12:60 |
考点:物质的量的相关计算
专题:计算题
分析:NO、NO2、N2O3、N2O5和N2O含有相同质量的氮原子,则氮原子物质的量相等,令氮原子为1mol,结合化学式计算各物质含有的O原子物质的量,根据m=nM可知,含有的氧原子质量之比等于其物质的量之比.
解答:
解:NO、NO2、N2O3、N2O5和N2O含有相同质量的氮原子,则氮原子物质的量相等,令氮原子为1mol,则:
NO的物质的量为1mol,含有O原子物质的量为1mol;
NO2的物质的量为1mol,含有O原子物质的量为1mol×2=2mol;
N2O3的物质的量为
=0.5mol,含有O原子物质的量为0.5mol×3=1.5mol;
N2O5的物质的量为
=0.5mol,含有O原子物质的量为0.5mol×5=2.5mol;
N2O的物质的量为
=0.5mol,含有O原子物质的量为0.5mol;
根据m=nM可知,含有相同质量的氮原子的NO、NO2、N2O3、N2O5和N2O中含有的氧原子质量之比=物质的量之比=1mol:2mol:1.5mol:2.5mol:0.5mol=2:4:3:5:1,
故选B.
NO的物质的量为1mol,含有O原子物质的量为1mol;
NO2的物质的量为1mol,含有O原子物质的量为1mol×2=2mol;
N2O3的物质的量为
| 1mol |
| 2 |
N2O5的物质的量为
| 1mol |
| 2 |
N2O的物质的量为
| 1mol |
| 2 |
根据m=nM可知,含有相同质量的氮原子的NO、NO2、N2O3、N2O5和N2O中含有的氧原子质量之比=物质的量之比=1mol:2mol:1.5mol:2.5mol:0.5mol=2:4:3:5:1,
故选B.
点评:本题考查物质的量有关计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
下列物质的导电性最差的是( )
| A、氯化钾固体 |
| B、0.1mol/L 盐酸 |
| C、0.1mol/L 醋酸 |
| D、溶化的氢氧化钠 |
元素性质呈现周期性变化的根本原因是( )
| A、元素的相对原子质量的变化 |
| B、核外电子排布的变化 |
| C、核电荷数的变化 |
| D、元素化合价的变化 |
下列化学用语表述正确的是( )
| A、蔗糖的分子式:C6H12O6 |
B、NH3的电子式: |
C、甲烷的比例模型: |
| D、二氧化碳的结构式:O-C-O |
醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,加入少量下列固体物质,能使平衡逆向移动的是( )
| A、NaCl |
| B、Na2C03 |
| C、NaOH |
| D、CH3COONa |
在18℃时,H2SO3的Kl=1.5×10-2、K2=1.0×10-7,H2S的Kl=9.1×10-8、K2=1.1×10-12,则下列说法中正确的是( )
| A、亚硫酸的酸性弱于氢硫酸 |
| B、亚硫酸溶液的酸性一定强于氢硫酸溶液 |
| C、氢硫酸的酸性弱于亚硫酸 |
| D、多元弱酸的酸性主要由第二步电离决定 |
“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用与催化及军事科学中.“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料.下列分散系中,分散质的微粒直径与“纳米材料”具有相同数量级的是( )
| A、胶体 | B、悬浊液 |
| C、乳浊液 | D、溶液 |
将表面积和体积均相等的大理石,分别投入过量的甲溶液(0.1mol/L HCl)与乙溶液(0.1mol/L醋酸)中,则( )
| A、初始的速率甲、乙相同,生成二氧化碳的总量甲、乙也相同 |
| B、初始的速率甲大于乙,生成二氧化碳的总量也是甲大于乙 |
| C、初始的速率甲大于乙,生成二氧化碳的总量甲、乙相同 |
| D、反应速率和生成二氧化碳的总量均不相同 |
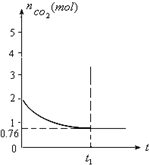 一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应:
一定温度下2升的恒容容器甲中,加入2moL碳和2moLCO2发生如下反应: