题目内容
15.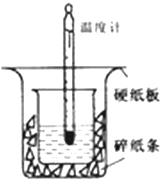 50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.
50ml0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如下图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和热.回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒.装置中还存在的2个错误是小烧杯未与大烧杯杯口相平,烧杯间未填满碎纸条
(2)在实验过程中,该同学需要测定并记录的实验数据有BDF(填序号).
A.盐酸的浓度
B.盐酸的温度
C.氢氧化钠溶液的浓度
D.氢氧化钠溶液的温度
E.水的比热容
F.反应后混合溶液的终止温度
(3)使用补全仪器后的装置进行实验,取50ml0.50mol•L-1盐酸与50mL0.55mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的 比热容为4.18J/(g•℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=-56.8kJ•mol-1,
(4)实验中改用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量不相等(填“相等”或“不相等”),所求中和热相等(填“相等”或“不相等”).
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会偏小;(填“偏大”“偏小”或“无影响”).
分析 (1)根据量热计的构造及实验关键来判断该装置的缺少仪器;
(2)根据中和热测定的原理来分析;
(3)根据Q=m•c•△T计算,先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)放出的热量与反应生成的水成正比,中和热是生成1mol液态水放出的热量;
(5)弱电解质电离需要吸收热量.
解答 解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;中和热测定实验成败的关键是保温工作;为减少热量损失,小烧杯未与大烧杯杯口相平,烧杯间未填满碎纸条;
故答案为:环形玻璃搅拌棒;①小烧杯未与大烧杯杯口相平;②烧杯间未填满碎纸条;
(2)在该实验过程中,该同学需要测定的实验数据有酸、碱的初始温度以及反应后混合溶液的终止温度,故答案为:BDF;
(3)50mL0.25mol/L H2SO4溶液与 50mL 0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值△T为3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-$\frac{1.421kJ}{0.025mol}$=-56.8 kJ/mol;
故答案为:-56.8kJ/mol;
(4)实验中改用60mL0.50mol•L-1盐酸跟50mL0.55mol•L-1NaOH溶液进行反应,生成的水的物质的量0.0275mol,放出的热量与反应生成的水成正比,生成的水物质的量不同,则放出热量不同;
中和热是生成1mol液态水放出的热量,条件一定,中和热数值不变;
故答案为:不相等; 相等;
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,因为一水合氨为弱电解质,电离需要吸收部分热量,所以测得的中和热数值小于实际数值,
故答案为:偏小.
点评 本题考查中和热的测定与计算,题目难度中等,注意理解中和热的概念,注意掌握测定中和热的正确方法,明确实验操作过程中关键在于尽可能减少热量散失.

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
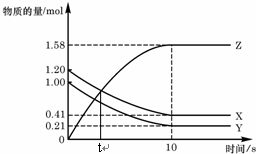 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图,下列描述正确的是( )| A. | t秒时该反应达到化学平衡状态 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol/L | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?2Z(g) |
| A. | 前20 min的平均反应速度$\overline v$(C)=0.1 mol/(L•min) | |
| B. | A的转化率为50% | |
| C. | C的平衡浓度c(C)=4 mol/L | |
| D. | B的平衡浓度c(B)=1.0 mol/L |
| A. | $\frac{a+b}{5×100%}$ | B. | $\frac{2(a+b)}{5b×100%}$ | C. | $\frac{200(a+b)}{5b}$% | D. | $\frac{(a+b)}{5a×100%}$ |
| A. | E2F2 | B. | E2F3 | C. | EF3 | D. | EF2 |
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | 早晨的树林里会看到太阳透过树叶射出的美丽光束 | |
| B. | 浑浊的水可以用明矾净化 | |
| C. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀 | |
| D. | 尿毒症患者做“血液透析” |



