题目内容
3.二氧化硅又称硅石,是制备硅及其化合物的重要原料,下列说法正确的是( )| A. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| B. | 玛瑙和红宝石的主要成分都是SiO2,是制备半导体的材料 | |
| C. | 高温下SiO2能与Na2CO3反应放出CO2,说明硅酸酸性强于碳酸 | |
| D. | Na2SiO3溶液中逐滴加入盐酸可制备硅酸胶体 |
分析 A.两性氧化物与碱和酸反应生成物为盐和水;
B.二氧化硅不导电;
C.常温下,水溶液中强酸能制取弱酸;
D.硅酸钠与盐酸反应生成硅酸和氯化钠;
解答 解:A.二氧化硅与氢氟酸反应生成四氟化硅和水,不符合两性氧化物概念,不是两性氧化物,故A错误;
B.二氧化硅不导电是绝缘体,硅为良好的半导体材料,故B错误;
C.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,故C错误;
D.硅酸钠与盐酸反应生成硅酸和氯化钠,可以用来制备硅酸胶体,故D正确;
故选:D.
点评 本题考查了硅及其化合物,熟悉物质的性质是解题关键,注意硅与氢氧化钠溶液反应的实质,注意两性物质的概念,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
14.X、Y、Z、W均为短周期元素,X+、Y2+、Z-、W2-具有相同的核外电子排布,下列比较中正确的是( )
| A. | 稳定性H2W<HZ | B. | 原子半径Y<Z | C. | 单质的还原性X<Y | D. | 最外层电子数Z<W |
11.科学家发现C60后,近年又合成了许多球形富勒烯分子,如C70等,下列对C70说法正确的是( )
| A. | 它与金刚石互为同素异形体 | |
| B. | 它与C60互称同分异构体 | |
| C. | 它与C60的物理性质与化学性质完全相同 | |
| D. | 它与13C互为同位素 |
18.下列各组反应(表中物质均为反应物),在反应刚开始时,放出H2的速率最大的是( )
| 金属(粉末状)mol | 酸的浓度及体积 | 反应温度 | |
| A | Zn 0.1 | 6mol/L硝酸 10mL | 70℃ |
| B | Zn 0.1 | 3mol/L硫酸 10mL | 70℃ |
| C | Fe 0.1 | 3mol/L盐酸 10mL | 60℃ |
| D | Zn 0.1 | 3mol/L盐酸 10mL | 60℃ |
| A. | A | B. | B | C. | C | D. | D |
8.如表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:①N,⑥Si,⑦S.
(2)在①-⑫元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者之间相互反应的化学方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O.
(4)在这些元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 四 | ⑩ | ⑪ | ⑫ |
(2)在①-⑫元素中,最活泼的金属元素是K(填元素符号,下同),最活泼的非金属元素是F.
(3)在这些元素的最高价氧化和对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3,二者之间相互反应的化学方程式为:3HClO4+Al(OH)3=Al(ClO4)3+3H2O.
(4)在这些元素中,原子半径最小的是F.
(5)在③与④中,化学性质较活泼的是Na,怎样用化学实验证明?钠跟水剧烈反应,放出氢气,并生成强碱NaOH;Mg跟水缓慢反应,放出氢气,并生成中强碱Mg(OH)2.
15.在短周期主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数,这四种元素原子的最外层电子数之和为20.下列判断中正确的是( )
| A. | 原子半径:丙>乙>甲>丁 | |
| B. | 气态氢化物的熔点:丙>甲 | |
| C. | 乙元素在自然界中形成的化合物种类最多 | |
| D. | 乙和甲、丙、丁都一定能形成两种或两种以上的共价化合物 |
13.满足分子式为C4H8ClBr的有机物共有( )
| A. | 11种 | B. | 12种 | C. | 13种 | D. | 14种 |

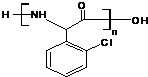 ;D→E所需X物质的结构简式:
;D→E所需X物质的结构简式:
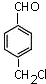 .
.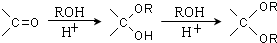
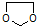 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: