题目内容
19.若甲、乙、丙三种物质间的转化关系是甲?乙?丙,则甲、丙不可能是( )| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
分析 A、氯气与水反应生成次氯酸,次氯酸见光分解生成氧气;
B、氢氧化铝受热分解生成氧化铝,氧化铝与盐酸反应生成氯化铝;
C、氯化铁与氢氧化钠反应生成氢氧化铁;
D、氢氧化钠与过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠受热分解生成碳酸钠.
解答 解:A、氯气与水反应生成次氯酸,次氯酸见光分解生成氧气,可以实现甲?乙?丙,所以符合条件,故A正确;
B、氢氧化铝受热分解生成氧化铝,氧化铝与盐酸反应生成氯化铝,可以实现甲?乙?丙,所以符合条件,故B正确;
C、氯化铁与氢氧化钠反应生成氢氧化铁,盐与碱反应直接可得氢氧化铁,无需中间过程,故C错误;
D、氢氧化钠与过量的二氧化碳反应生成碳酸氢钠,碳酸氢钠受热分解生成碳酸钠,可以实现甲?乙?丙,所以符合条件,故D正确;
故选C.
点评 本题系统的考查了元素化合物的性质,氧化物的概念,要求同学要将元素化合物的性质掌握的很熟练,需要细心周密的考虑问题.

练习册系列答案
相关题目
9.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)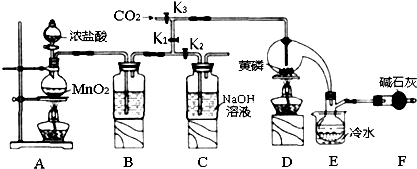
已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是球形干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PCl3的质量分数为79.75%.

已知:①黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5;
②PCl3遇水会强烈水解生成 H3PO3和HC1;
③PCl3遇O2会生成POCl3,POCl3溶于PCl3;
④PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置F的名称是球形干燥管,其中装的碱石灰的作用是吸收多余的氯气、防止空气中的H2O进入烧瓶和PCl3 反应;
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃;
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3;
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O;
(6)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定;
③重复②、③操作,平均消耗Na2S2O3溶液8.40ml.
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应,根据上述数据,该产品中PCl3的质量分数为79.75%.
7.下列实验操作先后顺序正确的是( )
| A. | 先装好药品,再检查装置的气密性 | |
| B. | 先用双手握紧试管,再将导管插入水中检查装置气密性 | |
| C. | 结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管 | |
| D. | 稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌 |
14.表是A、B、C、D、E五种有机物的有关信息:
根据表中信息回答下列问题:
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$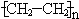 .
.
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: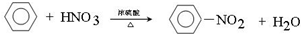 .
.
(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
| A | B | C | D | E |
| ①能使溴水褪色 ②比例模型为  ③能与水在一定条件下反应生成物质C | ①由C、H两 种元素组成 ②球棍模型为 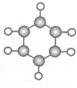 | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与E反应生成相对分子质量为100的酯 | ①相对分子质量 比物质C小2②能由物质C氧化而成 | ①由C、H、O三种元素组成 ②球棍模型为  |
(1)A与水在一定条件下反应生成的物质C是乙醇(填名称);写出在一定条件下,A生成高分子化合物的化学方程式:nCH2=CH2$\stackrel{催化剂}{→}$
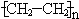 .
.(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤任何条件下不与氢气反应 ⑥可使酸性高锰酸钾溶液和溴水均褪色
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)写出由C氧化生成D的化学方程式:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(5)C与E反应能生成相对分子质量为100的酯,该反应类型为取代(酯化)反应;其化学方程式为:CH2=CH-COOH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH2=CH-COOC2H5+H2O.
8.常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
①2Fe2++H2O2+2H+=2Fe3++2H2O
②2Fe3++H2O2=2Fe2++O2↑+2H+
下列说法不正确的是( )
| A. | H2O2在反应①中作氧化剂,在反应②中作还原剂 | |
| B. | 在H2O2分解过程中,溶液的pH逐渐减小 | |
| C. | 在H2O2分解过程中,Fe2+起到催化剂的作用 | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
9.下列解释事实的方程式不正确的是( )
| A. | 向饱和CaCl2溶液中通入少量的CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 用Fe2(SO4)3做净水剂:Fe3++3H2O?Fe(OH)3(胶体)+3H+ | |
| C. | 水垢中的CaSO4用Na2CO3溶液处理:CaSO4+CO32-═CaCO3+SO42- | |
| D. | 向5 mL 0.1 mol•L-1的K2Cr2O7溶液中滴加5滴浓硫酸,溶液橙色变深:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+ |
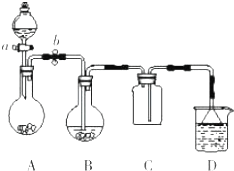 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).