题目内容
常温下,下列四种溶液:①0.10mol/L (NH4)2SO4 ②0.10mol/L NH3?H2O ③0.10mol/L CH3COONH4 ④0.10mol/L NH4HSO4.请根据要求填空:
(1)溶液①呈 (填“酸性”、“中性”或“碱性”),其原因是(用离子方程式表示): .
(2)若将溶液②稀释10倍,则稀释后的溶液中c(OH-) 原来的十分之一(填“大于”、“小于”或“等于”).
(3)实验测得溶液③的pH=7,则c(CH3COO-) c(NH4+)(填“>”、“<”或“=”).
(4)上述四种溶液中,pH最小的是(填序号) .
(5)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号) .
(6)将溶液②④混合,写出反应的离子方程式: .
(1)溶液①呈
(2)若将溶液②稀释10倍,则稀释后的溶液中c(OH-)
(3)实验测得溶液③的pH=7,则c(CH3COO-)
(4)上述四种溶液中,pH最小的是(填序号)
(5)上述四种溶液中,c(NH4+)由大到小的顺序为(填序号)
(6)将溶液②④混合,写出反应的离子方程式:
考点:盐类水解的原理,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:①铵盐硫酸铵中铵根离子水解导致溶液显示酸性;
②加水稀释会促进弱电解质的电离;
③根据溶液中的电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)来回答;
④四种溶液中,pH最小,即酸性最强,氢离子浓度最大;
⑤根据电离出铵根离子的数目以及其他离子对铵根离子水解的影响知识来回答;
⑥氨水是碱,硫酸氢铵具有强酸性,二者之间能反应.
②加水稀释会促进弱电解质的电离;
③根据溶液中的电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)来回答;
④四种溶液中,pH最小,即酸性最强,氢离子浓度最大;
⑤根据电离出铵根离子的数目以及其他离子对铵根离子水解的影响知识来回答;
⑥氨水是碱,硫酸氢铵具有强酸性,二者之间能反应.
解答:
解:①铵盐硫酸铵中,由于铵根离子水解而导致溶液显示酸性,即NH4++H2O?NH3?H2O+H+,故答案为:酸性;NH4++H2O?NH3?H2O+H+;
②加水稀释会促进弱电解质 NH3?H2O的电离,所以平衡正向进行会使得氢氧根离子浓度再增加,故答案为:大于;
③溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),显示中性时,c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;
④四种溶液中,pH最小,即酸性最强,氢离子浓度最大,硫酸氢铵中氢离子能直接完全电离出来,所以氢离子浓度最大,故答案为:④;
⑤电离出铵根离子的数目①最多,②最少,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以铵根离子浓度④>③,c(NH4+)由大到小的顺序是①④③②,故答案为:①④③②;
⑥溶液②④混合,氨水和硫酸氢铵中的氢离子反应,生成铵根离子和水,即 NH3?H2O+H+=NH4++H2O,故答案为:NH3?H2O+H+=NH4++H2O.
②加水稀释会促进弱电解质 NH3?H2O的电离,所以平衡正向进行会使得氢氧根离子浓度再增加,故答案为:大于;
③溶液中存在电荷守恒:c(CH3COO-)+c(OH-)=c(NH4+)+c(H+),显示中性时,c(OH-)=c(H+),所以c(CH3COO-)=c(NH4+),故答案为:=;
④四种溶液中,pH最小,即酸性最强,氢离子浓度最大,硫酸氢铵中氢离子能直接完全电离出来,所以氢离子浓度最大,故答案为:④;
⑤电离出铵根离子的数目①最多,②最少,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以铵根离子浓度④>③,c(NH4+)由大到小的顺序是①④③②,故答案为:①④③②;
⑥溶液②④混合,氨水和硫酸氢铵中的氢离子反应,生成铵根离子和水,即 NH3?H2O+H+=NH4++H2O,故答案为:NH3?H2O+H+=NH4++H2O.
点评:本题涉及弱电解质的电离平衡的移动、盐的水解原理以及应用、溶液中的电荷守恒等方面的知识,综合性强,难度不大.

练习册系列答案
相关题目
化学实验是探索物质世界的重要手段.下列实验方案设计正确的是( )
| A、向裂化汽油中滴加少量酸性高锰酸钾溶液,振荡.若紫红色褪去,即可证明其中含甲苯等苯的同系物 |
| B、选用新制Cu(OH)2悬浊液可以鉴别水、苯、溴苯、乙醛和乙酸 |
| C、采用普通蒸馏装置,将溴的四氯化碳溶液中的溶质与溶剂分离 |
| D、检验某铁粉样品中是否有少量氧化铁杂质,实验步骤为:取少许样品,用盐酸溶解,然后滴加KSCN溶液 |
下列关于药物的使用,不正确的是( )
| A、使用青霉素前一定要进行皮肤敏感试验 |
| B、为使药物易于吸收,最好用茶水送服 |
| C、少量鸦片可作镇痛药,过量则会中毒 |
| D、青霉素是一种高效的抗菌消炎药 |
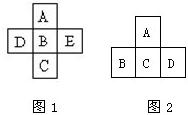 (Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示:
(Ⅰ)A、B、C、D、E五种元素在周期表里的位置如图1所示: