题目内容
5.下列有关说法正确的是( )| A. | 从海水中提取溴、碘都涉及置换反应,从矿物质中获取铝、铁、铜、硅都不涉及置换反应 | |
| B. | 利用溶解度数据可推测将一些混合物质分离开来的可能性,利用原子半径数据可推测某些原子的氧化性和还原性的强弱 | |
| C. | 因为食盐能使细菌变性,所以可以用食盐水杀死H7N9禽流感病毒 | |
| D. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 |
分析 A、从矿物质中获取硅的反应为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO;
B、降温结晶法,就是根据溶解度不同分离的;最外层电子数相同时,半径越大越易失电子;
C、病毒是一种蛋白质,要想杀死病毒,应使其失去生理活性,发生变性;
D、根据自发进行的条件是△H-T△S<0分析判断;
解答 解:A、从矿物质中获取硅的反应为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO,此反应为置换反应,故A错误;
B、如氯化钠和硝酸钾的溶解度随温度变化不同,可以通过降温结晶分离,所以利用溶解度数据可推测将一些物质混合物分离开来的可能性;最外层电子数相同时,半径越大越易失电子,其氧化性越弱,还原性越强,所以利用半径数据可推断某些原子的氧化性和还原性的强弱,故B正确;
C、食盐水只能够降低蛋白质的溶解度,不能使蛋白质变性,所以食盐水不能杀死H7N9禽流感病毒,故C错误;
D、△H>0、△S<0的反应,△H-T•△S>0,该反应一定不能自发进行,但在一定条件下可以正向进行,如:电解饱和食盐水,在通电的条件下可以正向进行,但是不能自发进行,故D错误;
故选B.
点评 本题考查蛋白质的变性、反应能否自发进行,难度不大,注意反应能否自发进行取决于焓变和熵变的综合判据,不能把其中一个因素当做判断反应能自发进行的依据,学习中注意该部分知识的积累.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
16.用NA表示阿伏加德罗常数,下列有关说法正确的是( )
| A. | 2.0 g D218O中含有的质子数为NA | |
| B. | 标准状况下,22.4 L NH3分子含有的杂化轨道数为4 NA | |
| C. | 78 g Na2O2晶体中所含阴、阳离子个数均为2 NA | |
| D. | 1 mol Fe完全溶于一定量的硝酸溶液中,转移的电子数一定是3 NA |
13.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
请回答下列问题:
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
| X | Y | |
| Z | W |
(1)元素Z位于周期表中第三周期VA族.
(2)Z、W形成的气态氢物的稳定性由强到弱顺序为H2S>PH3.(填化学式)
(3)XW2的化学式为CS2.
(4)Y的最高价氧化物的化学式为HNO3.
10.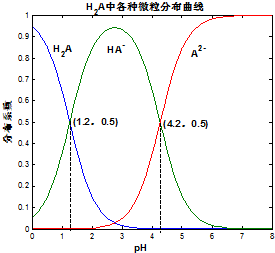 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
17.下列有关实验的描述不正确的是( )
| A. | 钠在空气和氯气中燃烧,火焰皆呈黄色,但生成固体颜色不同 | |
| B. | 新制饱和氯水和浓硝酸光照下会有气体产生,其成分中有氧气 | |
| C. | 次氯酸和过氧化钠都能使品红溶液褪色,其原理是不相同的 | |
| D. | 灼烧NaOH固体时不能使用瓷坩埚,因为坩埚中的SiO2能与NaOH反应 |
14.可用于分离MgCl2与AlCl3混合溶液的是( )
| A. | 氢氧化钠、盐酸 | B. | 盐酸、氨水 | ||
| C. | 氢氧化钠、氨水 | D. | 氢氧化钠、二氧化碳 |
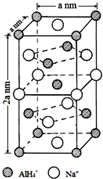 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15,.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. (标明配位键).
(标明配位键).