题目内容
现用98%的浓H2SO4(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸500mL.
(1)请将下列操作按正确的序号填在横线上:
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确顺序为
(2)简要回答下列问题:
①所需浓H2SO4的体积为 mL.
②如果实验室有15mL,20mL,25mL的量筒,选用 mL的量筒最好.量取时发现量筒不干净,用水洗净后直接量取将使实验最终结果 (填“偏高”、“偏低”或“无影响”).
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是 ,若搅拌过程中有液体溅出,会使最终结果 (填“偏高”、“偏低”或“无影响”).
④在转入容量瓶前烧杯中液体应 ,否则会使浓度 ;洗涤烧杯2~3次,洗液也要转入容量瓶,否则会使最终结果 (填“偏高”、“偏低”或“无影响”).
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使结果 ,仰视会使结果 (填“偏高”、“偏低”或“无影响”).
(1)请将下列操作按正确的序号填在横线上:
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确顺序为
(2)简要回答下列问题:
①所需浓H2SO4的体积为
②如果实验室有15mL,20mL,25mL的量筒,选用
③将浓H2SO4沿烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是
④在转入容量瓶前烧杯中液体应
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使结果
考点:配制一定物质的量浓度的溶液
专题:物质的量浓度和溶解度专题
分析:(1)根据实验操作的步骤进行实验步骤的排序.
(2)①浓H2SO4的物质的量浓度c=
,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;
②根据浓硫酸的体积选择量筒的规格;根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
③浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
④根据热溶液冷却后体积变小分析对配制溶液浓度的影响;根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
⑤根据c=
分析操作对溶质的物质的量或对溶液的体积的影响判断;
(2)①浓H2SO4的物质的量浓度c=
| 1000ρω |
| M |
②根据浓硫酸的体积选择量筒的规格;根据c=
| n |
| V |
③浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;根据c=
| n |
| V |
④根据热溶液冷却后体积变小分析对配制溶液浓度的影响;根据c=
| n |
| V |
⑤根据c=
| n |
| V |
解答:
解:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,将浓硫酸沿烧杯内壁慢慢注入盛有少量水的烧杯中,边加边用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中,向向容量瓶中加蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面正好跟刻度相平,盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签、贮存.实验操作正确的顺序为:AEFDCB.
故答案为:AEFDCB;
(2)①浓H2SO4的物质的量浓度c=
=
mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×0.5mol/L,解得:x≈13.6,所以应量取的浓硫酸体积是13.6mL,
故答案为:13.6mL;
①需浓硫酸的体积为13.6mL,所以需要选择20mL量筒;量取时发现量筒不干净,用水洗净后直接量取,溶质的物质的量偏低,配制溶液的浓度偏低;
故答案为:20;偏低;
③浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;若搅拌过程中有液体溅出,溶质的物质的量偏低,配制溶液的浓度偏低;
故答案为:防止暴沸,使稀释浓硫酸产生的热量及时散发出去;偏低;
④浓硫酸稀释过程中放出大量的热,在转入容量瓶前烧杯中液体应该冷却到室温,否则导致配制的溶液体积偏小,根据c=
可得,配制的溶液浓度偏高;洗涤烧杯2~3次,洗液未转入容量瓶,溶质的物质的量偏小,根据c=
可得,配制的溶液浓度偏低;
故答案为:静置冷却;偏高;偏低;
⑤定容时若俯视,导致加入的蒸馏水体积偏小,根据c=
可得,配制的溶液浓度偏高;定容时若仰视,导致加入的蒸馏水体积偏大,根据c=
可得,配制的溶液浓度偏低;
故答案为:偏高;偏低;
故答案为:AEFDCB;
(2)①浓H2SO4的物质的量浓度c=
| 1000ρω |
| M |
| 1000×1.84×98% |
| 98 |
故答案为:13.6mL;
①需浓硫酸的体积为13.6mL,所以需要选择20mL量筒;量取时发现量筒不干净,用水洗净后直接量取,溶质的物质的量偏低,配制溶液的浓度偏低;
故答案为:20;偏低;
③浓硫酸注入水中,放出大量热,用玻璃棒搅拌混合均匀搅拌,使热量迅速分散,防止液体飞溅;若搅拌过程中有液体溅出,溶质的物质的量偏低,配制溶液的浓度偏低;
故答案为:防止暴沸,使稀释浓硫酸产生的热量及时散发出去;偏低;
④浓硫酸稀释过程中放出大量的热,在转入容量瓶前烧杯中液体应该冷却到室温,否则导致配制的溶液体积偏小,根据c=
| n |
| V |
| n |
| V |
故答案为:静置冷却;偏高;偏低;
⑤定容时若俯视,导致加入的蒸馏水体积偏小,根据c=
| n |
| v |
| n |
| v |
故答案为:偏高;偏低;
点评:本题考查一定物质的量浓度溶液配制、物质的量浓度有关计算、仪器的选择和误差分析等,难度不大,误差分析为易错点.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案
相关题目
可逆反应A(g)+3B(g)?2C(g)+2D(g) 在不同情况下测得有下列4种反应速率,其中反应速率最快的是( )
| A、v(A)=0.5mol/(L?s ) |
| B、v(C)=6.0mol/(L?min) |
| C、v(B)=0.6mol/(L?s) |
| D、v(D)=0.4mol/(L?s) |
下列分离或提纯方法正确的是( )
| A、采用结晶的方法除去氯化钠溶液中的泥沙 |
| B、用酒精萃取溴水中的溴单质 |
| C、用蒸馏的方法分离乙酸(沸点118℃)与乙酸乙酯(沸点77.1℃) |
| D、用过滤的方法从含有少量氯化钠溶液的硝酸钾溶液中提取硝酸钾 |
短周期中的A、B、C、D、E五种元素,原子序数依次增大.A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能组成BA3化合物 |
| B、C、D、E形成的化合物水溶液可能显碱性 |
| C、A、B、C形成的化合物一定不能发生水解反应 |
| D、E的氧化物对应的水化物只具有氧化性 |
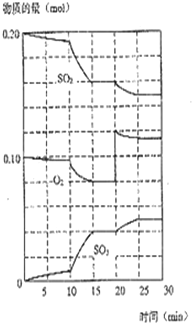 在一定条件下,二氧化硫和氧气发生如下反应:
在一定条件下,二氧化硫和氧气发生如下反应: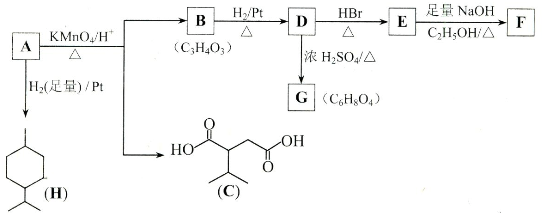
 I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象:
I、将锌片浸在硫酸铜中,用一根细铜棒抵住锌片的中部,发现铜棒变粗了,一段时间后,被铜棒抵住的部位出现了一个洞口.请你解释这两个现象: