题目内容
8.能正确表示下列反应的离子反应方程式为( )| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++OH-═NH3↑+H2O | |
| B. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6 Cl- | |
| D. | 向明矾KAl(SO4)2•12H2O]溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -═2 Al(OH)3↓+3BaSO4↓ |
分析 A.氢氧化钾过量,铵根离子和碳酸氢根离子都参与反应;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.氯气足量,亚铁离子和溴离子都完全反应;
D.硫酸根离子完全沉淀时,铝离子与氢氧根离子反应生成偏铝酸根离子.
解答 解:A.KOH过量,碳酸氢根离子也参与反应,正确的离子方程式为:HCO3-+NH4++2OH-=NH3↑+2H2O+CO32-,故A错误;
B.醋酸和碳酸钙都不能拆开,正确的离子方程式为:CaCO3+2CH3COOH=Ca2++H2O+CO2↑+2CH3COO-,故B错误;
C.向FeBr2溶液中通入足量氯气,反应生成氯化铁、溴单质,反应的离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
4.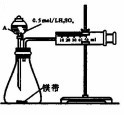 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
(1)镁与硫酸溶液反应的离子方程式为Mg+2H+=Mg2++H2↑.
(2)仪器A的名称为分液漏斗.
(3)0~t时间段与t~2t时间段,化学反应速率快的是t~2t;原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解反应速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3/0.2mol/L CuCl2,完成下表的实验设计:
①Fe3+、Cu2+在双氧水分解过程中起催化作用;
②本实验需测定的数据是收集相同体积的氧气所需时间;
③A中装有10mL双氧水,未减少误差,加入其它物质的方法是连接分液漏斗前,直接加到锥形瓶中.
 用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:
用如图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7g镁带,按图连接好装置,从A中加入20.0mL0.5mol/LH2SO4.记录注射器活塞的位置和相应的时间.实验记录如下:| 时间/s | t | 2t | … |
| 活塞的位置/mL | 25.6 | 36.0 | … |
(2)仪器A的名称为分液漏斗.
(3)0~t时间段与t~2t时间段,化学反应速率快的是t~2t;原因是镁与硫酸反应放热,温度升高,反应速率加快.
(4)用上述装置探究Fe3+、Cu2+对双氧水分解反应速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3/0.2mol/L CuCl2,完成下表的实验设计:
| 实验序号 | 双氧水体积/mL | 蒸馏水体积/mL | 添加的物质 |
| 1 | 10 | 0 | 4mLFeCl3 |
| 2 | 10 | 2 | 2mLCuCl2 |
②本实验需测定的数据是收集相同体积的氧气所需时间;
③A中装有10mL双氧水,未减少误差,加入其它物质的方法是连接分液漏斗前,直接加到锥形瓶中.
5.下列有关化学实验的操作或说法中,正确的是( )
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 向某溶液中加人稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| D. | 0.84g铁和50.00 mL 1.00 mol/L的稀硝酸反应,反应后溶液中一定只有Fe3+ |
2.下列有关电解质溶液说法正确的是( )
| A. | HCN溶液加水稀释,电离度保持不变,$\frac{c({F}^{-})}{c(HF)}$增大 | |
| B. | 向氨水中加入NH4Cl固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{{H}_{4}}^{+})}$增大 | |
| C. | NH4HCO3溶液呈碱性,由此可知Kb(NH3•H2O)>Ka1(H2CO3) | |
| D. | AgCl在饱和NaCl溶液中的溶解度及Ksp都比在纯水中的小 |
3.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.0 L 1.0 mol•L-1 的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时,10L pH=13的Ba(OH)2溶液中含有的OH-数为2NA | |
| C. | 常温常压下,11g D218O中所含中子数为6NA | |
| D. | 某无水乙醇与足量金属钠反应生成5.6L H2,则该乙醇分子中共价键总数为4NA |
13.下列各组物质中,第一种是含氧酸,第二种是混合物,第三种是碱的是( )
| A. | 盐酸、硫酸铜、硫酸 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、石灰水、烧碱 |
17.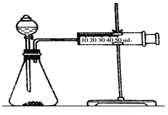 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
(1)该同学的实验目的是探究反应物本身的性质对反应速率的影响;
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积可以说明浓度对化学反应速率的影响.
实验二:同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难.现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热.已知:
P4(s,白磷)+5O2(g)═P4O10(s)△H1=-2983.2kJ•mol-1①
P(s,红磷)+$\frac{5}{4}$O2(g)═$\frac{1}{4}$P4O10(s)△H2=-738.5kJ•mol-1②
则白磷转化为红磷的热化学方程式为P4(s,白磷)═4P(s,红磷)△H=-29.2 kJ•mol-1相同状况下,能量状态较低的是红磷;白磷的稳定性比红磷低(填“高”或“低”).)
18.下列有关化学用语的表示,正确的是( )
| A. | 甲烷的电子式: | B. | CCl4分子的比例模型: | ||
| C. | 乙烯与丁二烯的最简式相同 | D. | 2-甲基丁醇的结构简式: |