题目内容
18.对于300mL 1mol•L-1盐酸与铁片的反应,其中能使反应速率加快的措施( )| A. | 升高温度 | B. | 再加300mL 1 mol•L-1盐酸 | ||
| C. | 用等量铁片代替铁粉 | D. | 改用100mL 98%的硫酸 |
分析 若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
解答 解:A.适当升高温度,增大活化分子百分数,反应速率加快,故A正确;
B.改用300mL 1 mol•L-1盐酸,酸的浓度不变,反应速率不变,故B错误;
C.用等量铁片代替铁粉,减小固体接触面积,使反应速率减小,故C错误;
D.改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故D错误.
故选A.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力和基本理论知识的综合运用的考查,难度不大,注意相关基础知识的积累,把握影响化学反应速率的因素.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.在物质分类中,前者包括后者的是( )
| A. | 氧化物、化合物 | B. | 化合物、混合物 | C. | 溶液、胶体 | D. | 分散系、胶体 |
13.化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式C8H8O2.A分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱如图.关于A的下列说法中,不正确的是( )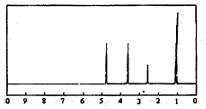

| A. | A分子属于酯类化合物 | |
| B. | A在一定条件下可与H2发生加成反应 | |
| C. | 符合题中A分子结构特征的有机物只有一种 | |
| D. | 与A属于同类化合物的同分异构体只有2种 |
10.单质X和Y化合生成化合物XY(X的化合价为+2),有下列叙述:
①X被氧化
②X是氧化剂
③X具有氧化性
④XY既是氧化产物也是还原产物
⑤XY中的Y2-具有还原性
⑥XY中的X2+具有氧化性
⑦Y的氧化性XY中的X2+氧化性强.
以上叙述正确的是( )
①X被氧化
②X是氧化剂
③X具有氧化性
④XY既是氧化产物也是还原产物
⑤XY中的Y2-具有还原性
⑥XY中的X2+具有氧化性
⑦Y的氧化性XY中的X2+氧化性强.
以上叙述正确的是( )
| A. | ①④⑤⑥⑦ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②⑤⑥⑦ |
7.下列做法正确的是( )
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 | |
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 | |
| C. | 服用阿斯匹林后出现胃肠道反应是中毒的表现,应立即停药 | |
| D. | 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |