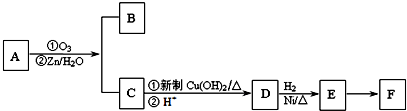
题目内容
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体.某研究性学习小组对蓝色固体的成分进行了如下探究.
(一)猜想与假设:
猜想一:固体为CuCO3,理由: (用化学反应方程式表示).
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈碱性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
(二)资料查阅:
Cu(OH)2和CuCO3晶体均不带结晶水,受热易分解,各生成对应的两种氧化物.
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经 、洗涤、低温烘干得蓝色固体.
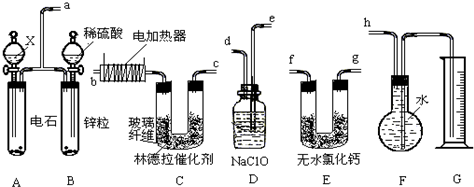
Ⅱ.用图1所示装置,定性探究固体的成分.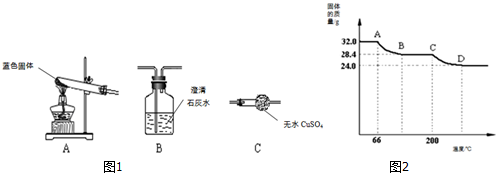
(2)若用装置A、B组合进行实验,B中无现象,则猜想 正确(填“一”、“二”),
若用装置A、C组合进行实验,C中无现象,则猜想 正确(填“一”、“二”);
(3)小组同学将装置按 A、 填“B”、“C”)的顺序组合进行实验验证出猜想三是正确的,实验中:B中的现象为 ,C中的现象为 .
结论:固体为Cu(OH)2和CuCO3的混合物.
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃∽220℃.设固体的组成为aCu(OH)2?bCuCO3.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,
请根据图2示回答下列问题:
(4)写出A B、C D段发生反应的化学方程式:
AB段: ;CD段: ;
(5)通过计算可得:a:b= ;
(6)若将24.0g 体继续加热到更高的温度,发现固体质量减少了2.4g后质量不再改变,写出此过程中可能发生反应的化学方程式: .
(一)猜想与假设:
猜想一:固体为CuCO3,理由:
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈碱性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
(二)资料查阅:
Cu(OH)2和CuCO3晶体均不带结晶水,受热易分解,各生成对应的两种氧化物.
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经
Ⅱ.用图1所示装置,定性探究固体的成分.

(2)若用装置A、B组合进行实验,B中无现象,则猜想
若用装置A、C组合进行实验,C中无现象,则猜想
(3)小组同学将装置按 A、
结论:固体为Cu(OH)2和CuCO3的混合物.
Ⅲ.固体成分定量测定:
已知Cu(OH)2的分解温度为66℃∽68℃,CuCO3的分解温度为200℃∽220℃.设固体的组成为aCu(OH)2?bCuCO3.小组同学用热分析仪对固体进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图,
请根据图2示回答下列问题:
(4)写出A B、C D段发生反应的化学方程式:
AB段:
(5)通过计算可得:a:b=
(6)若将24.0g
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(一)猜想与假设:假设一:根据复分解反应的原理分析;
(三)设计与实验:(1)根据物质的分离方法分析;
(2)根据氢氧化钙与二氧化碳反应生成碳酸钙沉淀分析;根据无水硫酸铜遇水变蓝分析;
(3)检验水要放在检验二氧化碳之前;
(4)根据氢氧化铜和碳酸铜的分解温度分析;
(5)根据氢氧化铜和碳酸铜的分解的化学方程式分析;
(6)将剩余固体继续加热,根据质量的减少计算,分析出反应的化学方程式.
(三)设计与实验:(1)根据物质的分离方法分析;
(2)根据氢氧化钙与二氧化碳反应生成碳酸钙沉淀分析;根据无水硫酸铜遇水变蓝分析;
(3)检验水要放在检验二氧化碳之前;
(4)根据氢氧化铜和碳酸铜的分解温度分析;
(5)根据氢氧化铜和碳酸铜的分解的化学方程式分析;
(6)将剩余固体继续加热,根据质量的减少计算,分析出反应的化学方程式.
解答:
解:(一)猜想与假设:假设一:碳酸钠与硫酸铜反应生成碳酸铜沉淀和硫酸钠,方程式为Na2CO3+CuSO4=CuCO3↓+Na2SO4;
故答案为:Na2CO3+CuSO4=CuCO3↓+Na2SO4;
(三)设计与实验:(1)过滤能除去不溶性杂质,将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体;
故答案为:过滤;
(2)B中无现象,说明没有二氧化碳生成,也就说明固体中没有碳酸铜;C中无现象,说明没有水生成,也就说明固体中没有氢氧化铜沉淀,
故答案为:二;一;
(3)检验水要放在检验二氧化碳之前,否则通过石灰水时会携带水蒸气,水分使C中白色的硫酸铜变为蓝色,二氧化碳使B中澄清石灰水变浑浊;故答案为:C、B;澄清石灰水变浑浊;白色的硫酸铜变为蓝色;
(4)AB段的温度大于60℃,小于100℃;符合氢氧化铜的分解温度,方程式为:Cu(OH)2
CuO+H2O;
CD段的温度超过了200℃,符合碳酸铜的分解温度,方程式为:CuCO3
CuO+CO2↑;
故答案为:Cu(OH)2
CuO+H2O;CuCO3
CuO+CO2↑;
(5)根据AB段:Cu(OH)2
CuO+H2O
1mol 18g
0.2mol 3.6g;
CD段:CuCO3
CuO+CO2↑
1mol 44g
0.1mol 4.4g,故a:b=0.2mol:0.1mol=2:1;
故答案为:2:1;
(6)将剩余固体继续加热,氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气,24g氧化铜的氧元素质量为:24g×
=4.8g,大于2.4g,说明氧化铜中的部分氧元素转化为氧气,方程式:4CuO
2Cu2O+O2↑;
故答案为:剩余固体;4CuO
2Cu2O+O2↑.
故答案为:Na2CO3+CuSO4=CuCO3↓+Na2SO4;
(三)设计与实验:(1)过滤能除去不溶性杂质,将反应后的固、液混合物经过滤、洗涤、低温烘干得蓝色固体;
故答案为:过滤;
(2)B中无现象,说明没有二氧化碳生成,也就说明固体中没有碳酸铜;C中无现象,说明没有水生成,也就说明固体中没有氢氧化铜沉淀,
故答案为:二;一;
(3)检验水要放在检验二氧化碳之前,否则通过石灰水时会携带水蒸气,水分使C中白色的硫酸铜变为蓝色,二氧化碳使B中澄清石灰水变浑浊;故答案为:C、B;澄清石灰水变浑浊;白色的硫酸铜变为蓝色;
(4)AB段的温度大于60℃,小于100℃;符合氢氧化铜的分解温度,方程式为:Cu(OH)2
| ||
CD段的温度超过了200℃,符合碳酸铜的分解温度,方程式为:CuCO3
| ||
故答案为:Cu(OH)2
| ||
| ||
(5)根据AB段:Cu(OH)2
| ||
1mol 18g
0.2mol 3.6g;
CD段:CuCO3
| ||
1mol 44g
0.1mol 4.4g,故a:b=0.2mol:0.1mol=2:1;
故答案为:2:1;
(6)将剩余固体继续加热,氧化铜加热后质量又会减少,应该是氧化铜中的氧元素转化为氧气,24g氧化铜的氧元素质量为:24g×
| 16 |
| 80 |
| ||
故答案为:剩余固体;4CuO
| ||
点评:本题考查探究物质的组成及性质,抓住题目的有效信息是解题的关键,分析是基础.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、铁发生氧化还原反应,一定失去NA个电子 |
| B、18gD2O含有的质子数为10NA |
| C、常温常压下,46gNO2和N2O4的混合物中含有的原子数为3NA |
| D、1mol/LNa2CO3溶液中含有的Na+数目为2NA |
Ag2S中混有少量AgCl,可以把该混合物加入以下哪种溶液中除去AgCl( )
| A、盐酸 |
| B、NaOH溶液 |
| C、Na2S溶液 |
| D、H2SO4溶液 |
下列物质可用重结晶法提纯的是( )
| A、含杂质的工业酒精 |
| B、含杂质的粗苯甲酸 |
| C、从溴水中提纯溴 |
| D、食盐中混有少量泥沙 |



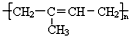 )为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为
)为主要成分的天然高分子化合物.天然橡胶单体A的名称用系统命名法可表示为