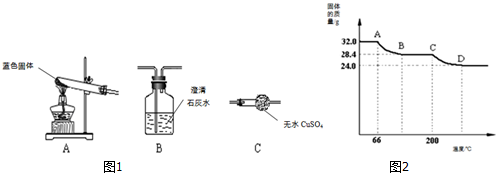
题目内容
Ag2S中混有少量AgCl,可以把该混合物加入以下哪种溶液中除去AgCl( )
| A、盐酸 |
| B、NaOH溶液 |
| C、Na2S溶液 |
| D、H2SO4溶液 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:除杂不增加新的杂质,同时被提纯的物质不能减少,Ag2S(s)?2Ag+(aq)+S2-(aq),KspAgCl=2.0×10-10,KspAg2S=2.0×10-48,依据氯化银的溶解度大于硫化银进行分析,2AgCl(s)+S2-?Ag2S(s)+2Cl-.沉淀溶解平衡向离子浓度减小的方向移动,从而除去AgCl.
解答:
解:A.氯化银沉淀溶解平衡中存在AgCl(s)?Ag+(aq)+Cl-(aq),加盐酸,氯离子浓度增大,平衡向沉淀方向进行,无法除去,故A错误;
B.加入NaOH溶液,氢氧化钠溶液与银离子形成氢氧化银沉淀,迅速转化为氧化银,无法除杂,故B错误;
C.加入硫化钠,硫化钠电离出硫离子,2AgCl(s)+S2-?Ag2S(s)+2Cl-,平衡向Ag2S沉淀方向进行,能除去,故C正确;
D.硫酸银微溶,加入硫酸溶液,硫酸与Ag2S、AgCl都不反应,无法除杂,故D错误;
故选C.
B.加入NaOH溶液,氢氧化钠溶液与银离子形成氢氧化银沉淀,迅速转化为氧化银,无法除杂,故B错误;
C.加入硫化钠,硫化钠电离出硫离子,2AgCl(s)+S2-?Ag2S(s)+2Cl-,平衡向Ag2S沉淀方向进行,能除去,故C正确;
D.硫酸银微溶,加入硫酸溶液,硫酸与Ag2S、AgCl都不反应,无法除杂,故D错误;
故选C.
点评:本题考查了沉淀转化的分析判断,题目难度不大.注意2AgCl(s)+S2-?Ag2S(s)+2Cl-,除杂不增加新的杂质,同时被提纯的物质不能减少为解答本题关键.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
按“单质、氧化物、盐”的顺序排列的一组物质是( )
| A、SO2 S Na2SO4 |
| B、Si SiO2 Na2SiO3 |
| C、CO2 Na2CO3 C |
| D、Al Al2O3 Al(OH)3 |
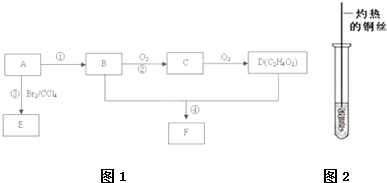
 已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.